Матура по Химия 25 август 2023 ПП
Тук можете да решите варианта на матруата по химия от напълно безплатно онлайн.
На ваше разположение са помощни таблици, които можете да отворите като кликнете на заглавията долу. Първи модул можете да решите изцяло онлайн. Втори модул няма как да бъде точно оценен автоматично, за това сме ви подготвили въпросите в таблицата в ляво и отговорите в дясно. Решенията записвайте и след това проверете колко точки сте събрали. Скалта за оценяване можете да видите в дъното на страницата. Успех!
Първи модул
Втори модул
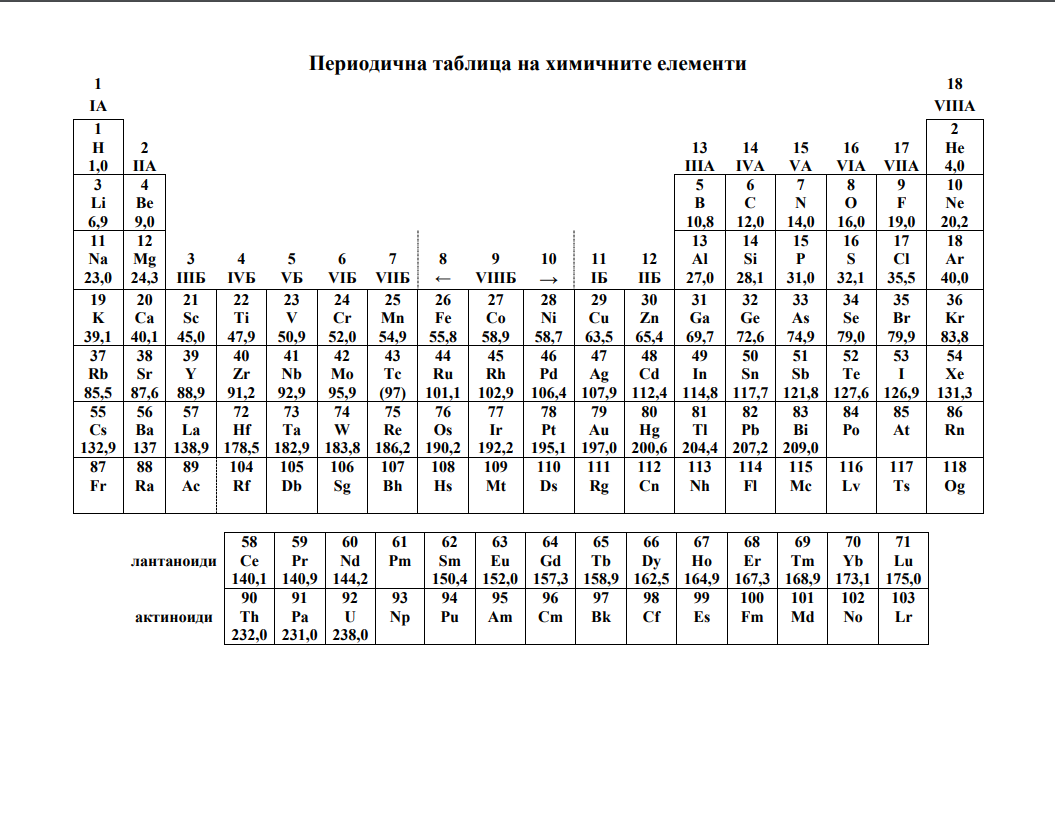
Съединенията на водорода с друг елемент се наричат хидриди. В зависимост от природата на
химичната връзка в състава им те се делят на йонни, ковалентни и метални хидриди.
1. Елемент с атомен номер 20 взаимодейства с водород до получаването на хидрида Х.
- 1.А. Изразете взаимодействието с уравнение.
- 1.Б. Определете вида на химичната връзка в хидрида Х и запишете с уравнения образуването на частиците, изграждащи хидрида Х.
- 1.В. Запишете с химично уравнение взаимодействието на хидрида Х с вода.
2. Сероводородът е разпространено в природата водородно съединение.
- 2А. Изберете подходящите думи (йонна; ковалентна полярна; ковалентна неполярна;
донорно-акцепторна; метална; σ-, π-), с които могат да се опишат химичните връзки в серводорода.
Запишете отговора в листа за отговори (втора част). - 2.Б. При разтваряне на сероводород във вода се получава разтвор с киселинни свойства.
Запишете с химични уравнения степенната електролитна дисоциация на получената киселина.
Запишете израза за дисоциационната константа на киселината по първата степен на дисоциация. - 2.В. Изразете с уравнение непълното горене на сероводород, при което се получава сяра.
3. Друго водородно съединение – водата, е универсален разтворител, в който добре се разтварят
вещества с йонна връзка и полярни молекули.
- 3.А. Коя е причината за по-високата температура на кипене на водата в сравнение със
сероводорода? - 3.Б. Приготвени са два водни разтвора, съдържащи захар (разтвор 1) и калциев дихлорид
(разтвор 2) с еднакви молални концентрации при 20 ℃. Кой от двата разтвора кипи при по-висока
температура при атмосферно налягане на морското равнище? Кой от двата разтвора има по-високо
парно налягане?
1. Метановата (мравчената) киселина е първият представител на алкановите карбоксилни
киселини. Тя се отделя като средство за химическа защита от някои насекоми и растения.
- 1.А. Запишете пълната структурна формула на мравчената киселина.
- 1.Б. Оградете функционалната група, която определя киселинните ѝ свойства, и я
наименувайте по IUPAC. - 1.В. Изразете електролитната дисоциация на киселината и дисоциационната ѝ константа.
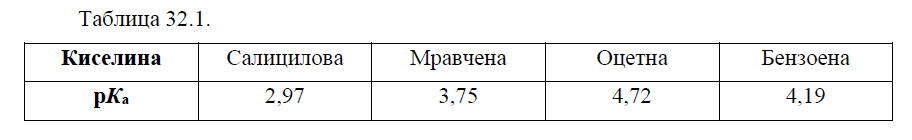
- 1.Г. По данните от Таблица 32.1. подредете киселините по засилване на киселинните им
свойства.
2. Поради специфичния си строеж мравчената киселина участва в окислително-редукционна
реакция с реактив на Толенс – диаминсребърен(I) хидроксид, подобно на алдехидите. Един от
получените продукти е въглероден диоксид.
- 2.А. Изразете взаимодействието с уравнение.
- 2.Б. Какви промени се наблюдават при провеждане на реакцията?
- 2.В. Кой химичен елемент е редуктор в този процес?
3. Някои естери на мравчената киселина са изкуствени ароматизатори за парфюми.
- 3.А. Бутилметаноатът има мирис на малини. Означете го със съкратена структурна формула.
- 3.Б. Изразете с уравнение естерификацията на мравчена киселина с пропан-2-ол и
наименувайте естера.
Най-важната сулфидна руда на цинка е сфалерит – ZnS.
1. За получаването на цинк сфалеритът се обработва по пържилно-редукционен метод. Пърженето
е взаимодействие на сфалерита с кислород при висока температура, при което се получава
съответния метален оксид и серен диоксид.
- 1.А. Изразете с химично уравнение процеса. Изравнете уравнението по метода на електронния
баланс. - 1.Б. Отделеният при пърженето серен диоксид се използва за получаване на сярна киселина.
За целта серният диоксид се окислява до серен триоксид и се отделя топлина. При определени
условия за реакцията е възможно настъпване на състояние на химично равновесие. За системата в
равновесие предложете три фактора, които водят до увеличение на добива на серен триоксид.
2. Цинковият сулфид може да се получи при взаимодействие на водни разтвори на цинков дихлорид и динатриев сулфид.
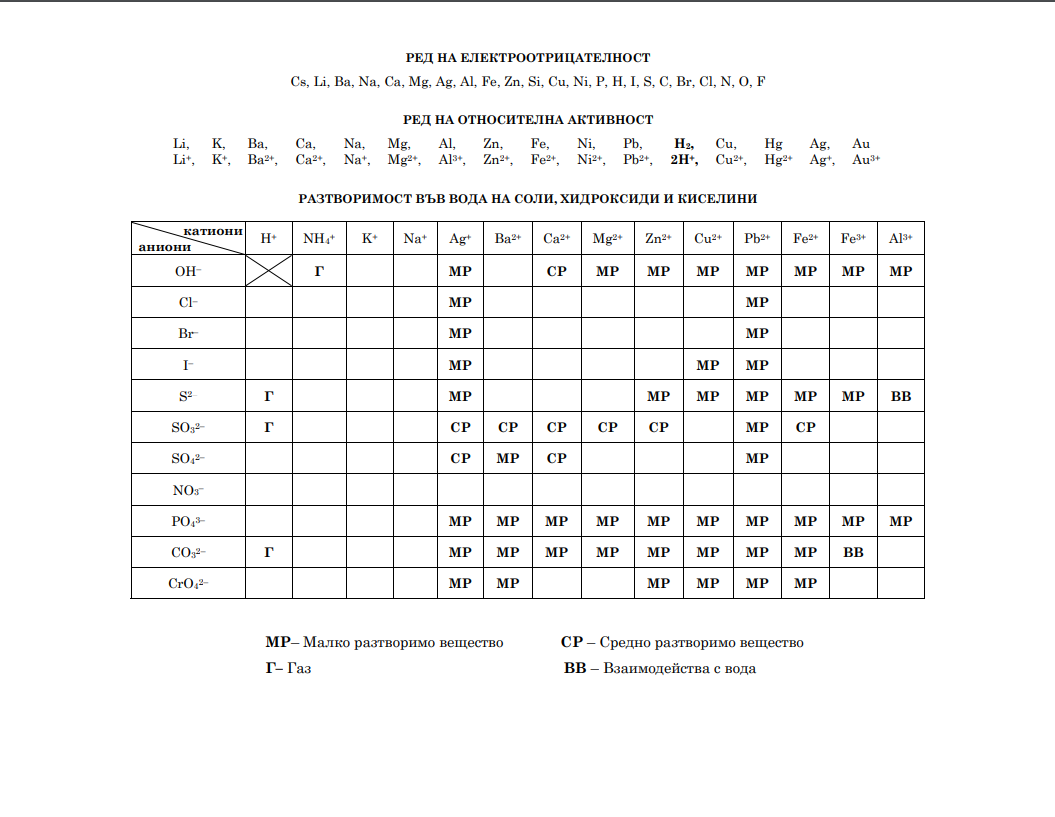
- 2.А. Ще се получи ли утайка от цинков сулфид при смесване на 100 mL разтвор на цинков
дихлорид с молна концентрация 2,2.10-6 mol/L и 100 mL разтвор на динатриев сулфид с молна
концентрация 5,5.10-6 mol/L? (Ks(ZnS) = 1,6.10-24)? Докажете с подходящи изчисления, като
пренебрегнете хидролизата на йоните. - 2.Б. Изразете със съкратени йонни уравнения по един начин за доказване на цинкови и
сулфидни йони в разтвори, различен от процеса в т. 2.А.
3. Малкоразтворимият цинков сулфид може да се разтвори при повишаване киселинността на
средата. Означете с химично уравнение разтварянето на утайката от цинков сулфид в сярна
киселина.
1. Етанолът, глицеролът и фенолът са представители на органичните съединения с
хидроксилна/хидроксилни групи в молекулите.
- 1.А. Запишете съкратена (или скелетна) структурна формула на многовалентния алкохол от
изброените три съединения. - 1.Б. Подредете трите съединения по засилване на полярността на връзката О–Н в молекулите
им. Използвайте знак <, >, =.
2. Пример за основните свойства на етанола и глицерола е взаимодействието им със солна киселина.
Неподелената двойка електрони при кислородния атом свързва протона от разтвора на киселината.
- 2.А. Означете с уравнение взаимодействието на етанол със солна киселина, като запишете и
образуващата се междинна оксониева сол.
3. Водният разтвор на фенола е известен в практиката като карболова киселина и е използван в
миналото като дезинфекциращо средство.
- 3.А. Като киселина фенолът взаимодейства с основи. Изразете взаимодействието му с разтвор на натриева основа.
- 3.Б. В Таблица 34.1. са дадени стойностите на рКа за фенол и заместени феноли.

Подредете съединенията по отслабване на киселинните им свойства.
4. Фенолът и неговите производни имат разнообразно практическо приложение.
- 4.А. Тъй като фенолът е силно отровен, употребата му като дезинфектант е преустановена. На базата на фенол се разработват по-ефективни и по-безопасни негови производни дезинфектанти.
Едно такова вещество е 3-метил-4-хлорофенолът. Запишете съкратената структурна (или скелетна)
формула на този дезинфектант. - 4.Б. Означете с химично уравнение взаимодействието на фенол с бензоен анхидрид.
Полученият естер се използва в козметиката като консервант.