РЕШЕНИЯ ДЗИ химия 20.05.2022 ПП
В хармониката по-долу ще намерите верните отговори и подробни решения на въпросите от матурата по Химия от 20 май 2023. Кликнете върху задачата и ще се отворят опциите с означен в зелено верния и подробно решение обосноваващо отговора
Използвайте решенията при неясноти или за идеи как да изградите стратегията си за решаване на матурата. Към всеки въпрос може да подходите по различен начин, в зависимост от къде решите да тръгнете. Ние сме използвали най-различни методи – от разнищване на условието до подробно разглеждане на всяка една възможност и изключване една по една до достигане на верния отговор.
Решения на Първи Модул
А) s-елемент от 2 група, 4 период
Б) d-елемент от 8 група, 4 периодВ) p-елемент от 16 група, 6 периодГ) d-елемент от 14 група, 6 период
РЕШЕНИЕ:
Елементът Е, чийто двузаряден йон Е2+ има електронна конфигурация [Ne]3s23p63d6, е d-елемент от 8 група, 4 период.
Тази конфигурация сочи към атом, който, след като загуби два електрона, достига стабилното състояние на инертен газ (неон [Ne]), с допълнителни електрони в 3d поднивото. Това показва, че елементът принадлежи към d-блока на периодичната система. Освен това, 3d6 конфигурацията след загуба на два електрона показва, че в нейното основно състояние тя е била 3d8, което отговаря на елементи в 8 група на периодичната таблица. Елементите от 4 период с 3d електрони са част от d-блока, което допълнително подчертава, че Е е d-елемент от 8 група на 4 период.
Така правилният отговор на въпроса е Б) d-елемент от 8 група, 4 период.
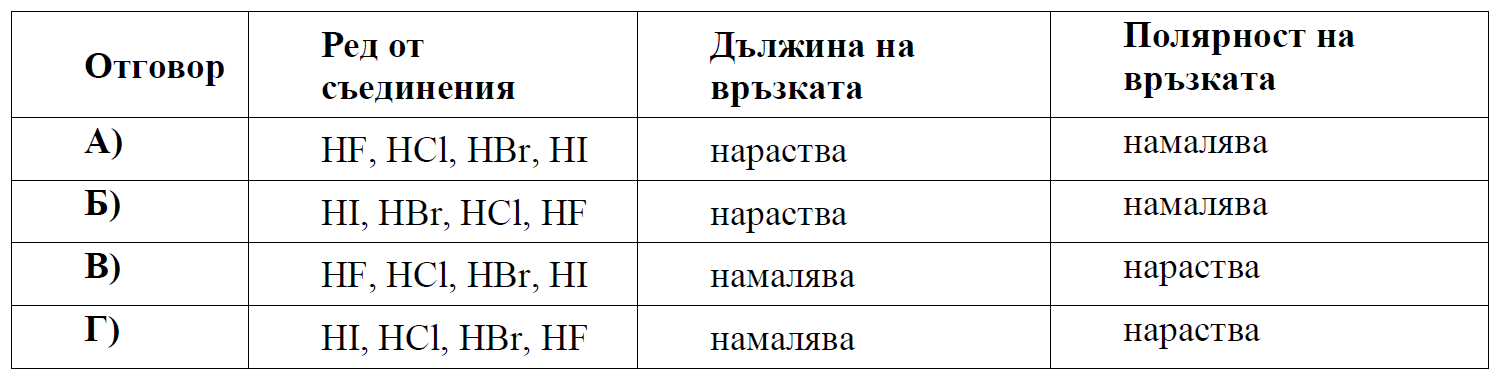
А) NaH2PO4 и H3PO4Б) Fe(OH)3 и Ca(OH)2В) Na2O2 и NaCH3COO
Г) Ca(HCO3)2 и Ca(CH3COO)2
РЕШЕНИЕ:
За да определим в кой ред и в двете съединения има три вида химични връзки (йонна, проста и сложна), нека разгледаме характеристиките и вида връзка, която се наблюдава във всяко от предложените съединения:
А) NaH2PO4 и H3PO4
- NaH2PO4 (дихидрогенфосфат натрий): Има йонни връзки между Na+ и останалата част на молекулата, както и ковалентни (прости и сложни) връзки вътре в аниона H2PO4^-.
- H3PO4 (фосфорна киселина): Има само прости и сложни ковалентни връзки между атомите на водорода, фосфора и кислорода.
Б) Fe(OH)3 и Ca(OH)2
- Fe(OH)3 (железен(III) хидроксид): Има йонна връзка между Fe3+ и OH^- групите, както и ковалентни връзки вътре в хидроксидните групи.
- Ca(OH)2 (калциев хидроксид): Също има йонна връзка между Ca2+ и OH^- групите, както и ковалентни връзки в хидроксидните групи.
В) Na2O2 и NaCH3COO
- Na2O2 (натриев пероксид): Има йонни връзки между Na+ и O22- и ковалентна връзка между кислородните атоми в пероксидния анион.
- NaCH3COO (натриев ацетат): Има йонни връзки между Na+ и ацетатния анион CH3COO^-, както и ковалентни връзки в самия ацетатен анион.
Г) Ca(HCO3)2 и Ca(CH3COO)2
- Ca(HCO3)2 (калциев бикарбонат): Има йонна връзка между Ca2+ и HCO3^- анионите, ковалентни връзки вътре в бикарбонатния анион, и допълнително водородни връзки между анионите.
- Ca(CH3COO)2 (калциев ацетат): Има йонна връзка между Ca2+ и CH3COO^- анионите, както и ковалентни връзки вътре в ацетатния анион.
От тази анализ, виждаме, че вариант Г) Ca(HCO3)2 и Ca(CH3COO)2 отговаря на условието за наличието на три вида химични връзки (йонна, проста и сложна) в и двете съединения, макар че термините „проста“ и „сложна“ ковалентна връзка могат да варират в тълкуванието си, като обикновено се говори за единични, двойни или тройни ковалентни връзки (прости) и ковалентни връзки, включващи повече сложно взаимодействие (например, координатно ковалентна).
А) само в BCl3Б) само във H2OВ) и в BCl3, и в NH3Г) и в NH3, и в H2O
РЕШЕНИЕ:
За да определим в кои от молекулите BCl3, NH3, H2O валентните атомни орбитали на централния атом са в ��2sp2-хибридно състояние, нека разгледаме валентните електрони и геометрията на всяка молекула.
BCl3 (Трихлорид на бор)
- Централният атом на бора има 3 валентни електрона, които участват в образуването на три ковалентни връзки с атомите на хлора.
- Геометрията на молекулата е тригонална планарна, което съответства на ��2sp2-хибридизация на валентните орбитали на бора.
NH3 (Амоняк)
- Централният атом на азота има 5 валентни електрона, от които 3 формират ковалентни връзки с водорода, а два остават като неподелена двойка.
- Геометрията на молекулата е тетраедрична заради неподелената двойка, което съответства на ��3sp3-хибридизация на валентните орбитали на азота.
H2O (Вода)
- Централният атом на кислорода има 6 валентни електрона, от които 2 формират ковалентни връзки с водорода, а останалите 4 са две неподелени двойки.
- Геометрията на молекулата е също тетраедрична заради неподелените двойки, което води до ��3sp3-хибридизация на валентните орбитали на кислорода.
От гореизложеното, виждаме, че само в BCl3 валентните атомни орбитали на централния атом са в ��2sp2-хибридно състояние. Така че, правилният отговор е А) само в BCl3.
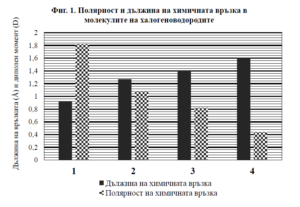
РЕШЕНИЕ:
Дължина на химичната връзка:
Дължината на химичната връзка е обикновено по-малка, когато атомите са по-малки. В серията на халогеноводородите, атомният размер на халогените нараства в реда F < Cl < Br < I. Така че, можем да очакваме, че дължината на връзката H-F ще бъде по-малка от H-Cl, която от своя страна е по-малка от H-Br и най-накрая H-I. Това е представено на диаграмата с черни барове, където бар 1 (най-нисък) представлява HF, а бар 4 (най-висок) – HI.
Полярност на химичната връзка:
Полярността на връзката се определя от разликата в електроотрицателност между двата атома, които формират връзката. Флуорът е елементът с най-висока електроотрицателност, следван от хлор, бром и йод, които имат все по-ниска електроотрицателност. Следователно, H-F връзката ще бъде най-полярна, тъй като разликата в електроотрицателността между водорода и флуора е най-голяма, докато H-I ще бъде най-малко полярна. Това е показано на диаграмата с шахматни барове, където бар 1 (най-висок) представлява HF, а бар 4 (най-нисък) – HI.
На база на гореизложеното верен е:
- Отговор А) HF, HCl, HBr, HI: Тук дължината на връзката нараства от HF към HI, което е в съответствие с увеличаването на атомния размер на халогените. В същото време, полярността на връзката намалява от HF към HI, което също е в съответствие с намаляването на разликата в електроотрицателността между водорода и всяка отделна халогенна група.
Решения на Втори Модул
ОЧАКВАЙТЕ СКОРО!
