Матура по Химия 03 юни 2020
Тук можете да решите варианта на матруата по химия от 03 юни 2020 година.
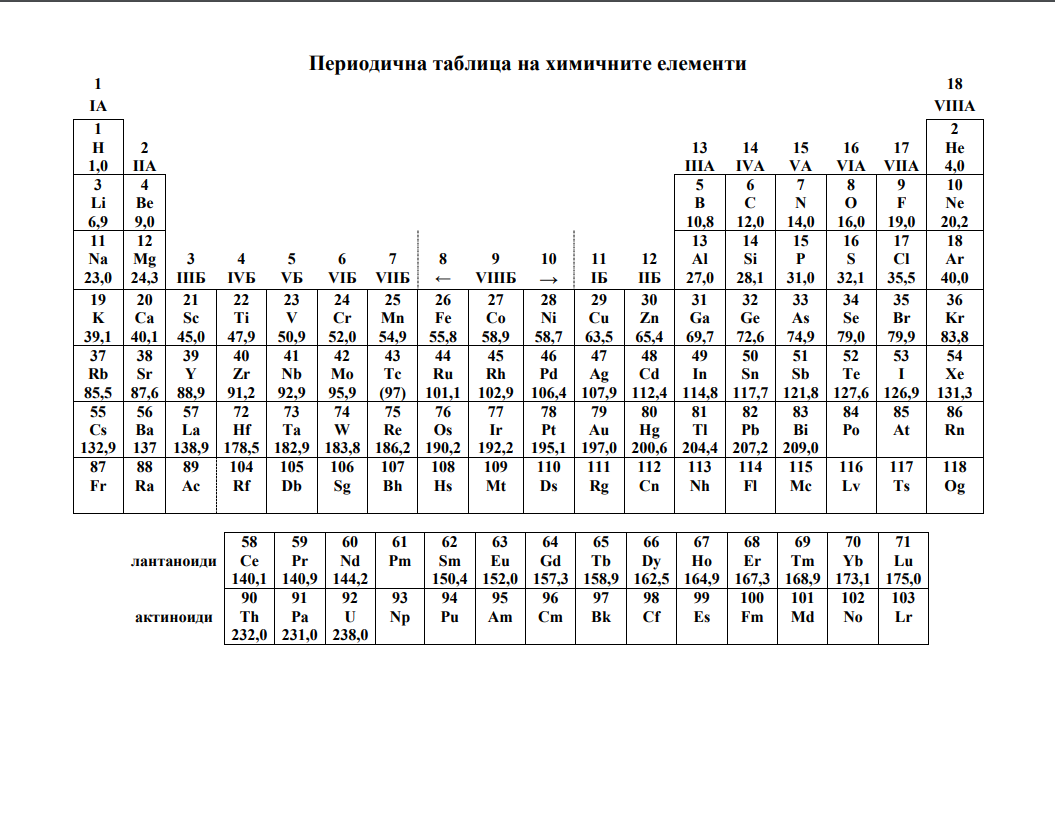
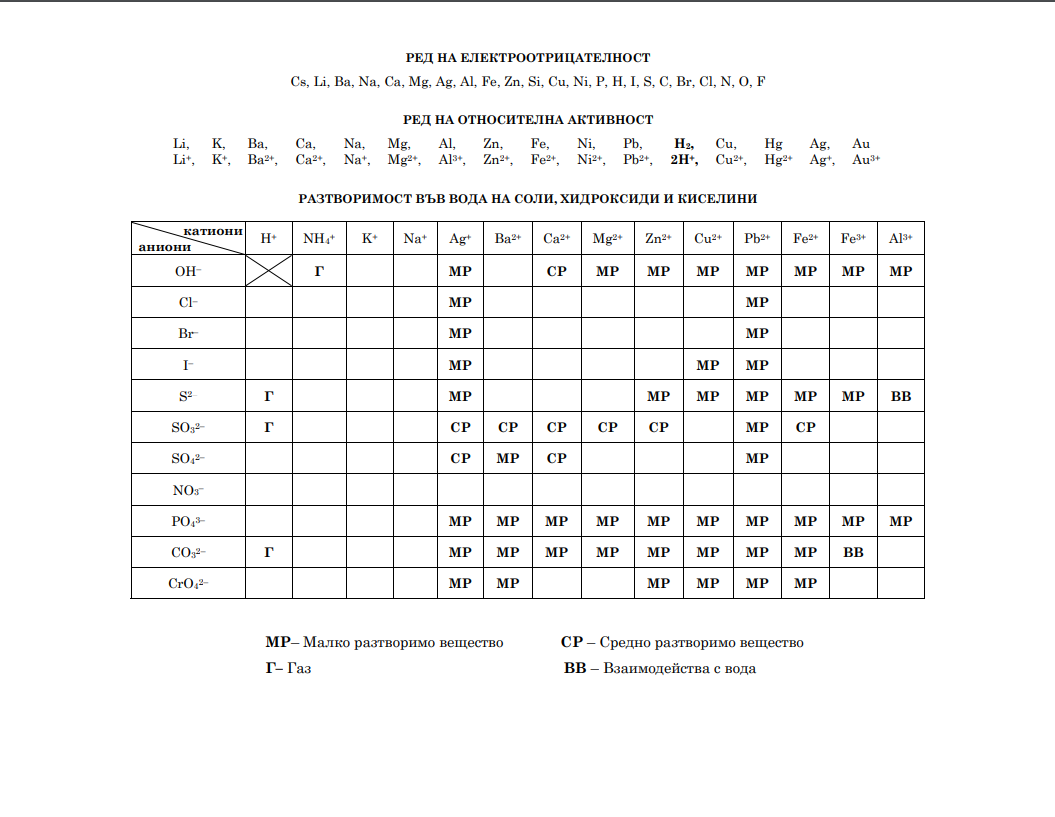
На ваше разположение са помощни таблици, които можете да отворите като кликнете на заглавията долу. Първи модул можете да решите изцяло онлайн. Втори модул няма как да бъде точно оценен автоматично, за това сме ви подготвили въпросите в таблицата в ляво и отговорите в дясно. Решенията записвайте и след това проверете колко точки сте събрали. Скалта за оценяване можете да видите в дъното на страницата. Успех!
ПЪРВИ МОДУЛ
Модулът съдържа 35 затворени въпроса с по един възможен отговор. Поради това, този раздел може да бъде оценен автоматично. Решете теста, запомнете получения брой точки и преминете към втори модул.
ВТОРИ МОДУЛ
Втори модул съдържа задачи с отворен отговор. Тях ще трябва да решите на лист и да оцените самостоятелно според дадения критерий. Запомнене броя точки от първи модул и добавяйте указания брой точки за всеки верен отговор.
За вашата подготовка е най-полезно да дадете вашите отговори преди да започнете да проверявате решенията и да точкувате.
Въпроси
36. Елементът Е се намира във втория период на Периодичната таблица. Простото вещество на Е реагира с неметали, вода и киселини, като образува йони, във всеки от които броят на
електроните е с един по-малко от броя на протоните.
А) Означете йоните на елемента Е с химичния им знак.
Б) Като замените Е с химичния му знак, изразете с химично уравнение взаимодействието на Е с вода.
37. На диаграмата са показани енергетичните промени в хода на процеса:
CaCO3(тв) <–> CaO(тв) + CO2(г)
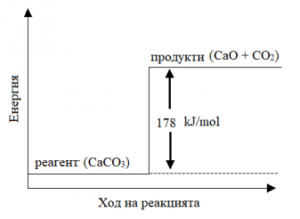
Отговорете на следните въпроси:
А) Какъв вид е правата реакция – ендотермична или
екзотермична?
Б) Колко е топлинният ефект Q на обратната реакция:
CaO(тв) + CO2 (г) → CaCO3(тв)?
В) Системата CaO(тв), CO2(г), CaCO3(тв) е в състояние на
химично равновесие. Повишаване или понижаване на
температурата ще благоприятства разлагането на
СаСО3?
38. При пълно изпарение на водата от 600 g наситен
за 20 °C разтвор на NaNO3 са получени 280 g сол.
А) Изчислете разтворимостта (s) на NaNO3 при 20 °C като g разтворено вещество в 100 g вода.
Б) Колко мола NaNO3 се съдържат в 600 g от наситения разтвор на NaNO3? (Закръглете резултата до
стотни).
39. Ученик потапя късчета виолетова лакмусова хартия във водни разтвори, приготвени от готварска сол, домат и препарат за почистване на фурни, съдържащ сода каустик. В таблица той записва цвета на лакмусовата хартия след изваждането ѝ от всеки от трите разтвора и извод за рН на разтвора, но е пропуснал да попълни колоната с наименованията на продуктите, от които
са приготвени разтвори 1, 2 и 3.

В свитъка за свободните отговори срещу цифрите 1, 2 и 3 напишете наименованието на съответния
продукт
40. В текста, който следва, липсват две думи и две химични формули:
Сa(NO3)2 е сол, която може да се получи от калциева основа, с химична формула (–- 1 –-) и (–- 2 –-)
киселина, с химична формула (–- 3 –-). Наименованието на солта Сa(NO3)2 e калциев (–- 4 –-).
В свитъка за свободните отговори срещу 2 и 4 запишете липсващите наименования, а срещу 1 и 3 – съответните химични формули.
41. Ученици имат за задача да получат три различни газа чрез химични реакции с участието на солна киселина. Освен с 15% солна киселина, те разполагат с три твърди вещества: магнезий,
динатриев карбонат и цинков сулфид.
Изразете с химични уравнения взаимодействието на трите твърди вещества със солна киселина
42. При „пърженето“ на оловна сулфидна руда освен оловен оксид, се получава още един оксид Б, който след окисление с простото вещество А до веществото В може да се използва за промишлено
получаване на сярна киселина.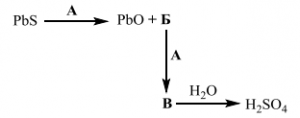
На схемата с описаните химични превръщания кои са веществата А, Б и В? Запишете химичните им формули в свитъка за свободните отговори
43. Кои от твърденията сa верни и кои – неверни? В свитъка за свободните отговори срещу буквите от А) до Е) запишете ДА за верните твърдения и НЕ за неверните твърдения.
А) Във въздуха се съдържа повече от 1 об.% CO2.
Б) Солна киселина се съдържа в стомашния сок.
В) Месингът и бронзът са сплави, съдържащи мед.
Г) Йодната тинктура представлява разтвор на йод във вода.
Д) Содата за хляб и содата каустик са наименования на различни вещества.
Е) В природата въглеродът се намира в свободно и в свързано състояние.
44. В следващия текст на местата 1, 2, 3 и 4 липсват думи и формули:
При окисление на метанол се получава метанал (–- 1 –-), наричан в практиката формадехид.
Продукт на окислението на метанал е (–- 2 –-) киселина. Химичната ѝ формула е (–- 3 –-), а
солите и естерите ѝ се наричат (–- 4 –-).
В свитъка за свободните отговори запишете срещу 1 и 3 съответните химични формули, а срещу 2 и 4
– липсващите думи от наименованията, като изберете от следните: CH3СОСН3, CH3СНО, HСНО,
HСООН, C2H5ОН, CH3СООН, С6Н5СООН, мравчена, оцетна, бензоена, формиати, етаноати, ацетати,
бензоати.
45. От структурните формули от (1) до (6) изберете по две, които изобразяват:
А) позиционни изомери
Б) верижни изомери
В) хомолози
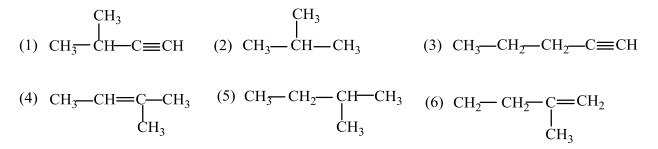
В свитъка за свободните отговори срещу буквите А, Б и В запишете двойките съединения със съответстващите им номера от (1) до (6).
46. Структурните формули от (1) до (6) изобразяват органични съединения, принадлежащи към различни класове.
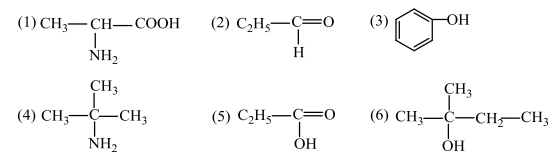
Изберете по едно съединение, което е:
А) амин
Б) аминокиселина
В) алдехид
Г) фенол
В свитъка за свободните отговори срещу съответния клас съединениия от А) до Г) запишете цифрата от 1 до 6 за избраното съединение.
47. При хлориране на етен (процес 1) се получава продукт, от който при температура около 500 °C и налягане 15-30 atm се отделя хлороводород и се получава хлороетен, известен в практиката като
винилхлорид (процес 2).
А) Изразете с химично уравнение процеса на присъединяване на хлор към етен (процес 1).
Б) Изразете с химично уравнение процеса на получаване на хлороетен при описаните условия
(процес 2).
При полимеризация на винилхлорид (хлороетен) се получава полимер, който е основната съставна част на една от най-използваните пластмаси.
В) Представете с химична формула полимера на хлороетена и напишете наименованието на този
полимер.
48. В представения преход от пропан чрез двата последователни химични процеса 1. и 2. се получава крайното съединение Б.
А) Изразете с химични уравнения процесите 1. и 2. , като заместите буквите А и Б с формулите на съответните съединения.
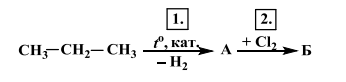
Б) Запишете един природен източник, от който се получава началното съединение на процес 1. .
В) Напишете наименованието на веществото Б според номенклатурата на IUPAC.
49. Изберете подходящите думи и изрази, с които трябва да се допълни текстът.

Изсичането на горите и намаляването на залесените площи е световен проблем, тъй като зелените части
на дърветата чрез процеса _____(1)_____ превръщат _____(2)_____ във въглехидрати и кислород. По
този начин дърветата съдействат за отслабване на _____(3)_____ и забавяне на климатичните промени,
причинени от прекомерната употреба на изкопаеми горива.
В свитъка за свободните отговори срещу (1), (2) и (3) запишете съответните думи или изрази.
50. На графиката са представени експериментални данни за температурата на кипене на представители на два хомоложни реда органични съединения с права въглеродна верига: алкани
и наситени първични моноалкохоли.
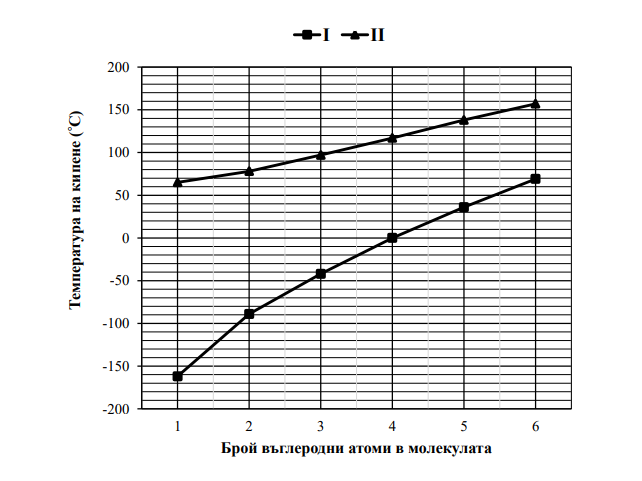
Като използвате графиката:
А) Запишете номера на кривата (I или II), която се отнася за хомоложния ред на алкохолите.
Б) Запишете броя на съединенията от криви I и II, които кипят над (+50)°С.
В) Запишете броя на съединенията от криви I и II, които са газове при температура (–20)°С.
Г) Коя е причината за по-ниските температури на кипене на съединенията от крива I в сравнение с тези
от крива II със същия брой въглеродни атоми в молекулата?
В свитъка за свободните отговори запишете съответната буква (а), (б), (в) или (г) на избрания отговор
между следните:
(а) – по-голяма молекулна маса и по-големи междумолекулни сили
(б) – по-малка молекулна маса и по-малки междумолекулни сили
(в) – по-голяма молекулна маса и по-здрави ковалентни връзки
(г) – по-малка молекулна маса и неполярни ковалентни връзки
Правилни отговори и точки
А) Li+ – 1т.
Б) 2Li+ 2H2O → 2LiOH + H2 – 2т.
А) ендотермична – 1 т.
Б) +178 kJ/mol – 1 т.
В) повишаване на температурата – 1т.
А) 87,5 g NaNO3/100 g вода – 2 т.
Б) 3,29 mol NaNO3 – 2т.
1 – препарат, съдържащ сода каустик; – 1т.
2 – домат; – 1т.
3 – готварска сол – 1т.
1 – Ca(ОH)2 – 1т.
2 – азотна – 1т.
3 – HNO3 – 1т.
4 – динитрат/нитрат – 1т.
Mg + 2HCl → MgCl2 + H2
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
ZnS + 2HCl → ZnCl2 + H2S
×2 т. за всяко вярно уравнение
А – O2 – 2т.
Б – SO2 – 2т.
B –SO3 – 2т.
А) Не – 1т.
Б) Да – 1т.
В) Да – 1т.
Г) Не – 1т.
Д) Да – 1т.
Е) Да – 1т.
1– HСНО; – 1т.
2 – мравчена; – 1т.
3 – HСООН; – 1т.
4 – формиати – 1т.
А) (4) и (6) – 1т.
Б) (1) и (3) – 1т.
В) (2) и (5) – 1т.
А) 4 – 1т.
Б) 1 – 1т.
В) 2 – 1т.
Г) 3 – 1т.
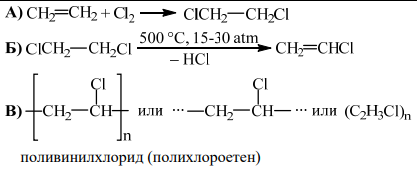
А) 2 т.
Б) 2 т.
В) 2×1=2 т.
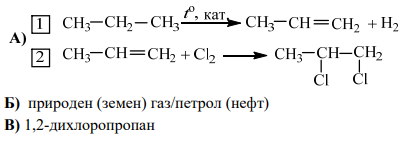
А) 2×2 = 4 т.
Б) 1 т.
В) 1 т.
(1) – фотосинтеза; – 1т.
(2) – въглеродния диоксид; – 1т.
(3) – парниковия ефект – 1т.
А) крива II – 1т.
Б) седем – 1т.
В) три – 1т.
Г) (б) – 1т.
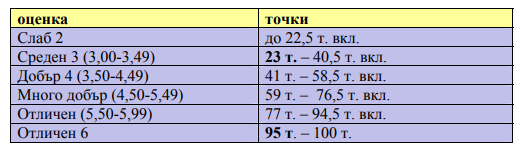
Резултат
Сега е момента да направите изчислението. Към точките от първата част доббавете точките от втората, която решихте на лист. Сравнете с таблицата в дясно. Тя е официалната таблица за оценяване на МОН.
Доволни ли сте от получения резултат?