РЕШЕНИЯ ДЗИ химия 23.05.2023 ПП
В хармониката по-долу ще намерите верните отговори и подробни решения на въпросите от матурата по Химия от 25 август 2023. Кликнете върху задачата и ще се отворят опциите с означен в зелено верния и подробно решение обосноваващо отговора
Използвайте решенията при неясноти или за идеи как да изградите стратегията си за решаване на матурата. Към всеки въпрос може да подходите по различен начин, в зависимост от къде решите да тръгнете. Ние сме използвали най-различни методи – от разнищване на условието до подробно разглеждане на всяка една възможност и изключване една по една до достигане на верния отговор. 25
Решения на Първи Модул
А) s-елемент
Б) p-елементВ) d-елементГ) f-елемент
РЕШЕНИЕ:
Външният трети електронен слой на елемент Е има пет електрона. Това означава, че електронната конфигурация на външния слой е с формата ��2��5ns2np5, където �n е номерът на слоя. Тъй като става дума за третия слой, �=3n=3 и конфигурацията става 3�23�53s23p5.
Стъпка 2: Установяване на типа на елемента
Предвид информацията за строежа на атома на елементи от различните групи, елементът Е с пет електрона във външния си електронен слой е p-елемент. Това е така, защото p-електронните подслоеве могат да съдържат до шест електрона и са характерни за елементите, които образуват p-електронен подслой на последния си електронен слой.
Отговор
Следователно, химичният елемент Е, който има пет електрона във външния си трети електронен слой, е p-елемент. Това подсказва, че той принадлежи към групата на елементите, при които в последния електронен слой се изгражда p-подслой.
А) H2SO4
Б) Ca(OH)2
В) Ba(NO3)2
Г) NH4NO3
РЕШЕНИЕ:
Сред изброените вещества търсим такова, което е йонно съединение и съдържа в себе си йон, образуван чрез ковалентна връзка по донорно-акцепторен механизъм. Това означава, че един от атомите (донорът) предоставя електронна двойка за образуването на ковалентна връзка с друг атом (акцептор), което води до образуването на йон с ковалентна връзка в неговата структура.
- H2SO4 (серна киселина) е молекулно съединение, а не йонно.
- Ca(OH)2 (калциев хидроксид) се състои от Ca²⁺ йони и OH⁻ йони, като и двата йона са образувани без донорно-акцепторен механизъм на ковалентна връзка в самите йони.
- Ba(NO3)2 (бариев нитрат) съдържа Ba²⁺ йони и NO3⁻ йони, където нитратният йон е съставен чрез ковалентни връзки, но сам по себе си нитратният йон е образуван чрез обикновени ковалентни връзки, а не чрез донорно-акцепторен механизъм.
- NH4NO3 (амониев нитрат) включва NH4⁺ (амониеви йони) и NO3⁻ (нитратни йони). Амониевият йон (NH4⁺) е пример за йон, образуван по донорно-акцепторен механизъм. Един водороден атом (H⁺) се свързва с амоняка (NH3), като амонякът действа като донор на електронна двойка към водородния йон, образувайки амониев йон.
Отговорът е Г) NH4NO3 (амониев нитрат), тъй като това е йонно съединение, в което амониевият йон е образуван чрез ковалентна връзка по донорно-акцепторен механизъм.
А) H2ОБ) NH3
В) BCl3Г) CO2
РЕШЕНИЕ:
Хибридизацията на атомните орбитали е концепция, която обяснява формата на молекулите, като предполага смесване на атомните орбитали за формиране на нови, хибридни орбитали. sp²-хибридизацията включва смесването на една s орбитала и две p орбитали, което води до формирането на три еквивалентни sp²-хибридни орбитали, разположени под ъгъл от 120° една спрямо друга в една и съща равнина, което дава плоска триъгълна геометрия на молекулата.
H2O (вода): Валентните орбитали на кислорода в молекула на водата са в sp³-хибридно състояние, тъй като кислородът формира две ковалентни връзки с водород и има два неподелени електронни двойки. Това води до изкривена геометрия, а не до плоска триъгълна.
NH3 (амоняк): В молекулата на амоняка, валентните орбитали на азота са също в sp³-хибридно състояние, като формират три ковалентни връзки с водород и имат една неподелена електронна двойка. Геометрията на амоняка е пирамидална.
BCl3 (бор трихлорид): В молекулата на бор трихлорид, борът формира три ковалентни връзки с хлор без неподелени електронни двойки. Това съответства на sp²-хибридизацията, водеща до плоска триъгълна геометрия на молекулата.
CO2 (въглероден диоксид): Валентните орбитали на въглерода в молекула на въглероден диоксид са в sp-хибридно състояние, тъй като въглеродът формира две двойни връзки с кислород, което води до линейна геометрия на молекулата.
Вярно твърдение за sp²-хибридизацията на валентните атомни орбитали на централния атом е за молекулата Б) BCl3 (бор трихлорид).
А) енергията на връзката C–X и полярността ѝ намаляватБ) енергията на връзката C–X и полярността ѝ нарастватВ) енергията на връзката C–X намалява, а полярността ѝ нарастваГ) енергията на връзката C–X нараства, а полярността ѝ намалява
РЕШЕНИЕ:
За да отговорим на въпроса как се изменят енергията и полярността на връзката C–X в молекулите на халогеноалканите CH3CH2–X с увеличаване на атомния номер на халогенния елемент X, е важно да разгледаме два аспекта: електроотрицателността и размера на халогенните атоми.
Електроотрицателност: Електроотрицатлносттае мярка за способността на атом да привлича към себе си електроните в химична връзка. В редицата на халогените (F, Cl, Br, I) електроотрицателността намалява с увеличаването на атомния номер. Това означава, че флуорът (F) е най-електроотрицателен, а йодът (I) – най-малко електроотрицателенсред халогените.
Размер на атомите: С увеличаването на атомния номер в групата на халогените, размерът на атомите нараства. Това означава, че атомният радиус на флуора е най-малък, а на йода – най-голям.
Енергия на връзката C–X:
- Енергията на връзката зависи от силата на привличане между атомите. По-малкият атом (с по-голяма електроотрицателност) образува по-силни връзки поради по-близкото привличане на валентните електрони. Така, връзката C–F е с най-висока енергия от всички връзки C–X, а с увеличаването на размера на халогенния атом (например от Cl към I) енергията на връзката намалява.
Полярност на връзката C–X:
- Полярността на връзката зависи от разликата в електроотрицателността между двата атома. Като цяло, по-голямата разлика в електроотрицателността води до по-полярна връзка. В редицата на халогените, тъй като електроотрицателността намалява от F към I, разликата в електроотрицателността между въглерода и халогена също намалява, което означава, че полярността на връзката C–X намалява с увеличаването на атомния номер на X.
Отговорът на въпроса е А) енергията на връзката C–X и полярността ѝ намаляват с увеличаване на атомния номер на халогенния елемент X.
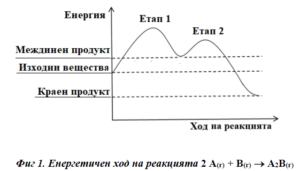
Определете вида на двата етапа на процеса според топлинния ефект.А) 1 – екзотермичен, 2 – ендотермиченБ) 1 – екзотермичен, 2 – екзотермичен
В) 1 – ендотермичен, 2 – екзотермиченГ) 1 – ендотермичен, 2 – ендотермичен
РЕШЕНИЕ:
На предоставената диаграма на енергетичния ход на реакцията можем да видим енергията на системата в два последователни етапа. Изходните вещества започват реакцията с определено начално ниво на енергия, а крайният продукт има по-ниско ниво на енергия.
Етапите се характеризират така:
Първият етап на реакцията можем да го определим като този, при който се достига до енергийния максимум – това е моментът, когато се образува междинният продукт. Ако тази точка е по-висока от началната енергия на изходните вещества, то първият етап е ендотермичен – това означава, че системата абсорбира енергия от околната среда.
Вторият етап е от момента на междинния продукт до достигането на енергията на крайния продукт. Тъй като крайният продукт има по-ниска енергия от междинния продукт, този етап е екзотермичен – при него се отделя енергия към околната среда.
Следователно, правилният отговор на въпроса е:
В) 1 – ендотермичен, 2 – екзотермичен.
![]()
Кой е правилният израз за равновесната константа (Kc) на този процес?
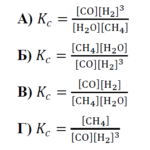
РЕШЕНИЕ:
Константата на равновесие ��Kc за реакция, която е в състояние на химично равновесие, е дадена от израза:
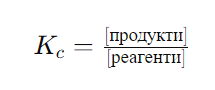
където концентрациите на продуктите и реагентите са повдигнати на степен, равна на техния стехиометричен коефициент в балансираното уравнение на реакцията. Концентрациите са в моларни единици (M).
За обратимата реакция в условието изразът за Kc ще бъде:
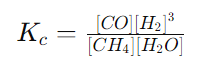
Тъй като ��CO и �2H2 са продуктите, техните концентрации са в брояча, а ��4CH4 и �2�H2O са реагенти, техните концентрации са в знаменателя. Концентрацията на �2H2 е повдигната на куб, тъй като той се образува с коефициент 3 в химичното уравнение. Това означава, че правилен е отговор А

Добивът на хлор ще се намали при:А) повишаване на налягането
Б) повишаване на температуратаВ) намаляване на концентрацията на водната параГ) увеличаване на концентрацията на хлороводорода
РЕШЕНИЕ:
За да се определи как промяната на условията ще влияе на добива на хлор в равновесието:
4 ���(г)+�2(г)⇌2 ��2(г)+2 �2�(г)Δ�°<04HCl(г)+O2(г)⇌2Cl2(г)+2H2O(г)ΔH°<0
можем да използваме принципа на Льо Шателие, който казва, че ако на система в равновесие се окаже външно въздействие (като промяна в концентрация, налягане или температура), системата ще се приспособи по начин, който да намали ефекта на това въздействие.
Ето как всяка промяна би повлияла на добива на хлор:
А) Повишаване на налягането: Тъй като общият брой молекули газ отляво на уравнението е повече (5 мола) от този отдясно (4 мола), увеличаването на налягането би изместило равновесието към продуктите (според Льо Шателие), където има по-малко молекули газ. Това означава, че добивът на хлор би се увеличил, а не намалил.
Б) Повишаване на температурата: Реакцията е екзотермична (ΔH° < 0), което означава, че отделя топлина. Повишаването на температурата би действало като добавяне на топлина към системата, така че системата ще се стреми да погълне допълнителната топлина, като се измести назад към реагентите, което би намалило добива на хлор.
В) Намаляване на концентрацията на водната пара: Ако концентрацията на водната пара намалее, равновесието ще се измести надясно, за да компенсира намалението, което би увеличило добива на хлор.
Г) Увеличаване на концентрацията на хлороводорода: Ако концентрацията на HCl се увеличи, равновесието отново ще се измести надясно, за да компенсира увеличението, което също би увеличило добива на хлор.
Така че, правилният отговор на въпроса как промяната на условията ще намали добива на хлор е:
Б) Повишаване на температурата.
А) с(А) се увеличи 2 пъти и с(В) се увеличи 2 пътиБ) с(А) се увеличи 4 пъти и с(В) се увеличи 4 пъти
В) с(А) се увеличи 2 пъти, а с(В) не се променяГ) с(А) се увеличи 4 пъти, а с(В) не се променя
РЕШЕНИЕ:
Ако кинетичното уравнение на реакцията е:
�=�⋅�2(�)⋅�(�)v=k⋅c2(A)⋅c(B)
и искаме скоростта �v да се увеличи четири пъти, тогава нека разгледаме каква промяна в концентрациите на �A и �B е необходима.
Вариант Б) предлага увеличение на �(�)c(A) четири пъти, което би увеличило членът �2(�)c2(A) шестнадесет пъти, тъй като (4�(�))2=16�2(�)(4c(A))2=16c2(A), и ако �(�)c(B) остане същата, това би довело до увеличение на скоростта на реакцията общо шестнадесет пъти, което е повече от необходимото увеличение от четири пъти.
Следователно, верният отговор на въпроса е:
В) с(�)с(A) се увеличи 2 пъти, а с(�)с(B) не се променя. Така, �2(�)c2(A) ще се увеличи четири пъти (тъй като (2�(�))2=4�2(�)(2c(A))2=4c2(A)), и това ще увеличи скоростта на реакцията �v също четири пъти.
А) по-висока температура на замръзванеБ) по-ниска температура на кипене
В) по-високо осмотично наляганеГ) повишено парно налягане
РЕШЕНИЕ:
Когато концентрираме разтвора на KCl (калиев хлорид), въздействието върху физикохимичните свойства на разтвора може да бъде описано с колигативните свойства, които зависят само от броя на разтворените частици в разтвора, а не от техния вид. Ето как промените в концентрацията на KCl влияят на всяко от изброените свойства:
А) Температура на замръзване: Увеличаването на концентрацията на разтворените частици води до понижаване на температурата на замръзване на разтвора. Това е известно като криоскопичен ефект.
Б) Температура на кипене: Повишената концентрация на разтворените частици повишава температурата на кипене на разтвора, което е известно като ебулиоскопичен ефект.
В) Осмотично налягане: При по-висока концентрация на разтворените частици, осмотичното налягане на разтвора също се увеличава. Това е поради по-големият градиент на концентрация, който причинява по-силен поток на вода (или разтворител) през полупропусклива мембрана.
Г) Парно налягане: Когато концентрацията на разтворените вещества се увеличи, парното налягане над разтвора намалява поради ефекта на Раулт. Това е защото има по-малко молекули на разтворителя на повърхността, които могат да изпарят.
Изхождайки от горните обяснения, правилният отговор за свойствата на по-концентриран разтвор на KCl в сравнение с изходния е:
В) По-високо осмотично налягане.

А) C6H5NH2 < NH3 < C2H5NH2Б) NH3 < C2H5NH2 < C6H5NH2В) C2H5NH2 < NH3 < C6H5NH2Г) C2H5NH2 < C6H5NH2 < NH3
РЕШЕНИЕ:
Основните свойства на амините могат да бъдат оценени по стойностите на техните константи на основност ��Kb. Колкото по-голяма е стойността на ��Kb, толкова по-силно е основното свойство на съединението.
В таблицата са дадени следните стойности на ��Kb за амоняк (NH3), етанамин (C2H5NH2) и анилин (C6H5NH2):
- Амоняк (NH3): ��=1.8×10−5Kb=1.8×10−5
- Етанамин (C2H5NH2): ��=5.6×10−4Kb=5.6×10−4
- Анилин (C6H5NH2): ��=3.8×10−10Kb=3.8×10−10
Според тези стойности:
- Етанамин има най-висока константа на основност и е най-силната основа от трите.
- Амонякът има средна стойност на ��Kb и е втората по сила основа.
- Анилин има най-ниската константа на основност и е най-слабата основа от дадените вещества.
Следователно, веществата са подредени по засилване на основните им свойства от най-слабата към най-силната основа като:
Анилин (C6H5NH2) < Амоняк (NH3) < Етанамин (C2H5NH2)
Така правилният отговор е:
А) �6�5��2<��3<�2�5��2C6H5NH2<NH3<C2H5NH2
А) d-елемент, металБ) p-елемент, неметалВ) p-елемент, метал
Г) s-елемент, метал
РЕШЕНИЕ:
Важно е да се отбележи, че когато третият електронен слой е незавършен, но устойчив, това обикновено съответства на наличието на осем електрона в този слой, което е така наречената „устойчива октета“. Това е типично за благородните газове, които имат устойчива външна обвивка.
Елементът Е има два електрона във външния, четвърти слой, което означава, че той започва да запълва s-подслой в този четвърти слой. Следователно, това е s-елемент. Тъй като той все още не е запълнил s-подслоя си (т.е., не е достигнал до s2 конфигурацията), той вероятно е метал, тъй като металите са характеризирани с незавършени външни слоеве, което позволява лесното отдаване на електрони и образуване на катиони.
Така правилният отговор е:
Г) s-елемент, метал.
А) Е е метал, s-елементБ) Е е метал, p-елемент
В) Е е неметал, p-елементГ) Е е метал, d-елемент
РЕШЕНИЕ:
От информацията, че елементът Е образува газообразно съединение с водород с формула H2E, можем да заключим, че Е вероятно е в главна група на периодичната система, защото елементите в главните групи често формират хидриди с формула H2E.
Вторият указател е формулата на оксида ЕО3, която предполага, че елементът Е може да достигне степен на окисление +6, защото има три кислородни атома, всеки със степен на окисление -2 (за общо -6). Това е типично за p-елементите в главна група VI (16), където се намира сярата (S), например, която образува SO3.
От друга страна, ако Е беше s-елемент, най-висшата му степен на окисление би била +2 (тъй като s-елементите могат да дарят максимум два електрона от своя s-подслой), и той не би могъл да образува EO3. Освен това, металите рядко образуват газообразни хидриди с формула H2E и обикновено не достигат степен на окисление, толкова висока, че да образуват оксиди с формула EO3.
От всичко това можем да заключим, че Е е неметал, p-елемент.
Следователно, правилният отговор е:
В) Е е неметал, p-елемент.
А) CaO – основенБ) PbO – амфотеренВ) ZnO – амфотеренГ) NO – неутрален
РЕШЕНИЕ:
Химичният елемент E образува оксид EO, който при стандартни условия е бяло прахообразно вещество, лесно карбонизира във въздух и реагира с вода, като реакцията дава основен резултат (виолетовият лакмус се оцветява в синьо). Това показва, че оксидът има основен характер. Освен това EO реагира с разредена солна киселина, което отново потвърждава основния характер, но не реагира с концентрирани разтвори на алкални основи, което може да се тълкува като липса на амфотерни свойства или като свойство характерно за силно основен оксид.
Тези наблюдения ни позволяват да изключим вариантите Б) и В), тъй като PbO и ZnO имат амфотерни свойства и биха могли да реагират със силни алкални разтвори под определени условия. NO, който е посочен като Г) е неутрален оксид и не образува воден разтвор, който променя цвета на лакмуса в синьо, т.е. не е основен.
Отпада и вариант Г), остава вариант А) CaO, който е основен оксид. Калциевият оксид (CaO), наричан още негасена вар, реагира с вода, за да образува калциев хидроксид Ca(OH)2, който е силно основен и би оцветил лакмуса в синьо. CaO също така реагира с разредена солна киселина, образувайки солта калциев хлорид (CaCl2) и вода, но е устойчив в концентрирани алкални разтвори, което съответства на описанието в задачата.
Така, верният отговор за химичния елемент E и неговият оксид EO, които съответстват на даденото описание, е:
А) CaO – основен оксид.
А) NO, CaH2, HClБ) CO2, NH3, HClO3
В) NO2, CaH2, HNO3Г) Al2O3, BeH2, HF
РЕШЕНИЕ:
За да отговорим на въпроса, трябва да разгледаме всяка от предложените комбинации и да определим дали формулите в реда отговарят на изискванията за киселинен оксид, хидрид с йонен строеж и монопротонна оксокиселина:
А) NO е неутрален оксид, а не киселинен, CaH2 е хидрид с йонен строеж, а HCl е халогеноводородна киселина (не е оксокиселина).
Б) CO2 е киселинен оксид, NH3 е амоняк, който е молекулен, а не йонен хидрид, HClO3 е оксокиселина хлорна киселина (но не е монопротонна, тъй като може да отделя повече от един протон).
В) NO2 е киселинен оксид (образува азотна киселина в реакция с вода), CaH2 е хидрид с йонен строеж, HNO3 е азотна киселина, която е монопротонна оксокиселина.
Г) Al2O3 е амфотерен оксид, а не строго киселинен, BeH2 е хидрид с йонен строеж, HF е флуороводородна киселина, която е проста монопротонна киселина, но не е оксокиселина, тъй като не съдържа кислород в молекулата си.
Въз основа на тези анализи, правилният отговор за реда, в който последователно са записани формулите на киселинен оксид, хидрид с йонен строеж и монопротонна оксокиселина е:
В) NO2, CaH2, HNO3
А) сравнително лесно се втечнява
Б) не гори и не поддържа горенетоВ) разтваря се във вода и взаимодейства с неяГ) взаимодейства с алкални основи
РЕШЕНИЕ:
Фактът, че въглеродът в CO2 е във висшата си степен на окисление (+4), значи, че въглеродът вече е съединен с максимално възможния брой кислородни атоми и не може да приеме още кислород. Това обяснява следните свойства:
А) Способността на въглеродния диоксид да се втечнява сравнително лесно е повече физическо свойство, което не е пряко свързано със степента на окисление на въглерода.
Б) CO2 не поддържа горенето и не гори, защото вече е въглерод в окислена форма. Няма къде повече да приеме кислород, така че това свойство е директно свързано с висшата степен на окисление на въглерода.
В) Разтворимостта на CO2 във вода и взаимодействието му с нея, където образува слаба киселина (въглеродна киселина, H2CO3), не е пряко свързано със степента на окисление на въглерода.
Г) Взаимодействието на CO2 с алкални основи, при което се образуват съответните карбонати, е реакция, която се случва благодарение на киселинните свойства на CO2 във вода. Това свойство може да бъде разглеждано като производно на киселинните свойства на въглеродния диоксид, но също не е директно свързано със степента на окисление на въглерода.
Сред предложените опции, най-пряко свързаното с висшата степен на окисление на въглерода (+4) е това, че CO2 не поддържа горене и не гори, тъй като вече е окислен до крайна степен.
Отговорът на въпроса е Б) не гори и не поддържа горенето.
А) SO2 + 2 NaOH ⇌ Na2SO3 + H2O
Б) SO2 + 2 H2S ⇌ 2 H2O + 3 SВ) SO2 + H2O ⇌ H2SO3Г) 2 SO2 + O2 ⇌ 2 SO3
РЕШЕНИЕ:
Окислително-редукционните (редокс) реакции включват промяна в степените на окисление на веществата, участващи в реакцията. Окислителите приемат електрони (намаляват степента на окисление на други вещества), докато редуцентите отдават електрони (увеличават степента на окисление на други вещества).
Ако разгледаме предложените реакции:
А) SO2 + 2 NaOH ⇌ Na2SO3 + H2O В тази реакция SO2 действа като киселина (формира сол и вода при реакция с основа), без промяна в степените на окисление.
Б) SO2 + 2 H2S ⇌ 2 H2O + 3 S Тук SO2 е окислен от H2S, който действа като редуцент. В резултат на реакцията, серата в SO2 намалява степента на окисление си от +4 (в SO2) до 0 (в елементарен серен), докато серата в H2S увеличава своята степен от -2 (в H2S) до 0 (в елементарен серен). Това означава, че SO2 действа като окислител.
В) SO2 + H2O ⇌ H2SO3 Тази реакция е просто формиране на въглеродна киселина от SO2 и вода, което е хидратация, а не окислително-редукционен процес.
Г) 2 SO2 + O2 ⇌ 2 SO3 Това е реакция на съединение, където SO2 приема кислород (окисление) и се превръща в SO3. В този случай SO2 е редуцент, а кислородът (O2) е окислител.
От всички тези реакции, SO2 действа като окислител само в реакция Б), където той окислява H2S до елементарен серен (S).
Следователно, правилният отговор е:
Б) SO2 + 2 H2S ⇌ 2 H2O + 3 S
А) Алуминият се използва за изработване на домакински съдове, защото е лек материал.Б) Използването на медта за пренос на електроенергия се обяснява с нейната топлопроводност.В) Графитът се използва за направа на електроди, тъй като е мек и мазен на пипане.
Г) Диамантът се използва за изработване на шлифовъчни и режещи дискове, защото е твърд.
РЕШЕНИЕ:
Нека разгледаме всяка от предложените опции и свойството, което обуславя избраната област на приложение:
А) Алуминий за домакински съдове: Алуминият наистина се използва за изработка на домакински съдове, и един от основните му избори е лекотата му, което го прави удобен за употреба в домакинството.
Б) Мед за пренос на електроенергия: Медта се използва широко за пренос на електроенергия, но това се дължи на нейната висока електропроводимост, а не на топлопроводността. Въпреки че медта също има добра топлопроводност, това не е основната причина за нейното използване в електрическите проводници.
В) Графит за електроди: Графитът се използва за направата на електроди, но това е поради неговата добра електрическа проводимост, а не заради мекотата и мазнината му на пипане. Това свойство е важно за употребата на графит в механични приложения като смазочни материали, но не е причина за използването му в електроди.
Г) Диамант за шлифовъчни и режещи дискове: Диамантът наистина се използва за шлифовъчни и режещи дискове, и това е точно защото е най-твърдият известен естествен материал, което му позволява да реже или шлайфа почти всичко.
Следователно, вярното твърдение за областта на приложение на веществото и свойството, което го обуславя, е:
Г) Диамантът се използва за изработване на шлифовъчни и режещи дискове, защото е твърд.
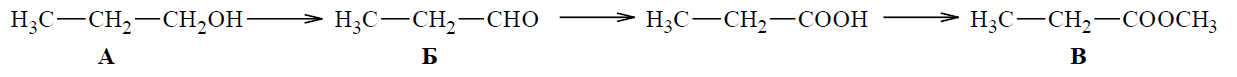
Б) A – алкохол Б – алдехид В – естер
РЕШЕНИЕ:
От схемата можем да идентифицираме следните вещества:
A: Има общата формула R-OH, където R е алкил група, което го определя като алкохол.
Б: Има общата формула R-CHO, където R е алкил група, което го определя като алдехид.
B: Има общата формула R-COO-R’, където и R, и R’ са алкилни групи, което го определя като естер.
Следователно, вярно определеният клас съединения за A, Б и B е:
Б) A – алкохол Б – алдехид В – естер.
А) C6H5CH2CH3 – толуенБ) C6H5NO2 – нитробензенВ) C6H5ОH – фенолГ) CH3COOC6H5 – фенилацетат
РЕШЕНИЕ:
Нека разгледаме всяка формула и да видим дали името съответства на структурата:
А) C6H5CH2CH3 – толуен
Тази формула представя бензилния радикал (C6H5CH2-) със свързан етил група (CH3). Толуенът е C6H5CH3, което означава, че е бензеновият пръстен с една метилна група (CH3). Следователно, това не е толуен.
Б) C6H5NO2 – нитробензен
Тази формула представя бензеновият пръстен (C6H5) с нитро група (NO2), което е коректното име за тази структура – нитробензен.
В) C6H5ОH – фенол
Формулата представя бензеновият пръстен с хидроксил група (OH), което правилно е наименовано като фенол.
Г) CH3COOC6H5 – фенилацетат
Тази формула представя естер, формиран от уксусна киселина (CH3COO) и фенол (C6H5), което коректно се нарича фенилацетат.
На база на тази информация, редът, в който няма съответствие между формулата и наименованието, е:
А) C6H5CH2CH3 – толуен.
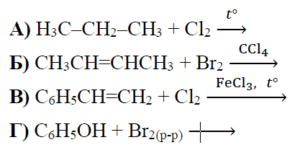
РЕШЕНИЕ:
Присъединителните реакции включват добавяне на атоми към двойна или тройна връзка в молекула. Нека разгледаме всяко от съединенията в опциите:
А) H3C-CH2-CH3 + Cl2: Това е пропан, който е алкан (наситено съединение с единствени връзки), и реакцията с хлор (Cl2) би била реакция на радикална субституция, а не присъединителна реакция.
Б) CH3CH=CHCH3 + Br2: Това е бутен, който е алкен (ненаситено съединение с една двойна връзка), и реакцията с бром (Br2) е присъединителна, при която двата атома на брома се присъединяват към въглеродните атоми от двойната връзка, образувайки 1,2-дибромобутан.
В) C6H5CH=CH2 + Cl2: Това е стирен, който също е алкен. Той също би могъл да участва в присъединителна реакция с хлор, но при наличието на бензеновия пръстен, реакцията може да бъде по-комплексна и не е стандартен пример за присъединителна реакция.
Г) C6H5OH + Br2(p-p): Фенолът (C6H5OH) реагира с бром в орто- и пара-позициите при електрофилно ароматно субституционна реакция, а не присъединителна реакция.
Сред тези опции, реакцията, която най-ясно представлява присъединителна реакция, е тази с бутена, където двойната връзка се разрушава и на нейно място се присъединяват два атома бром:
Б) CH3CH=CHCH3 + Br2 → CH3CHBr-CHBrCH3
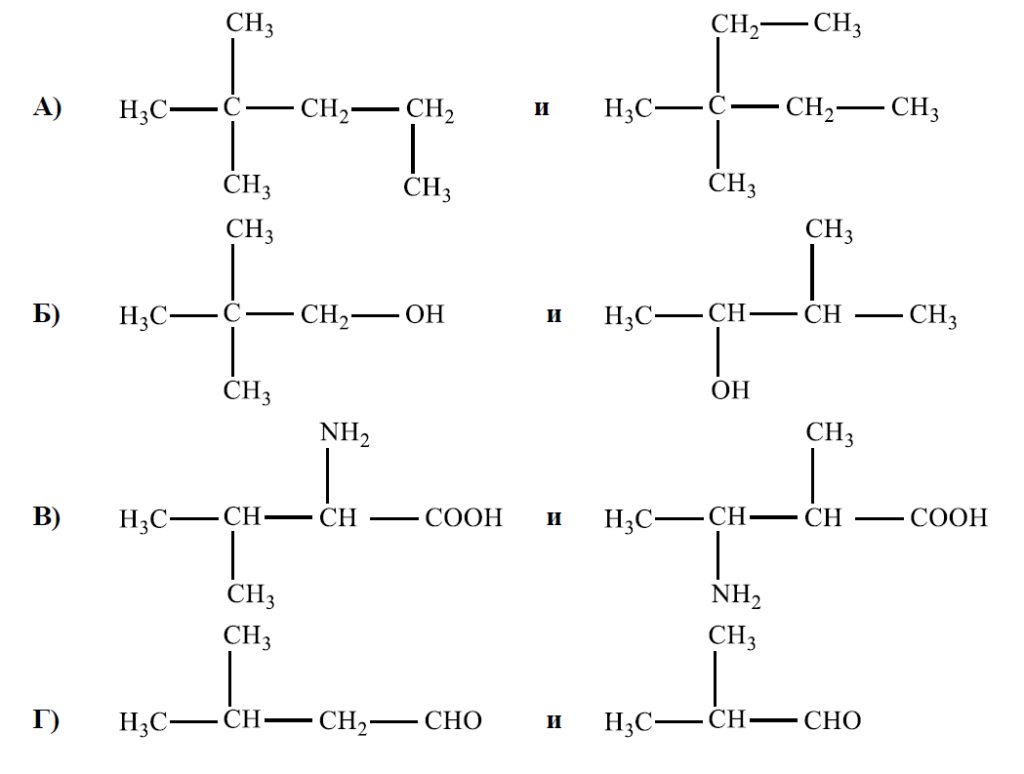
РЕШЕНИЕ:
Хомолозите са вещества, които принадлежат към един и същ клас органични съединения и се различават със степента на метиленовата група (-CH2-). В хомоложна поредица всеки следващ член има една метиленова група повече от предходния.
Ако разгледаме структурите, представени във въпроса:
А) Имаме два алкана. Първият е с дълга верига, съдържаща вторичен въглерод, свързан с две метилни групи, последван от три метиленови групи и една метилна група. Вторият е също алкан, също с вторичен въглерод, свързан с две метилни групи, но с две метиленови групи и една метилна група. Тези две съединения не са хомолози, защото разликата в тяхната структура не е само една метиленова група.
Б) Имаме алкохол и едно съединение, което изглежда като алкохол с една метиленова група по-малко. Въпреки че те са сходни, те не са хомолози, тъй като второто съединение има още една хидроксилна група, което променя основния клас на съединението.
В) Имаме една карбоксилна киселина и една аминокиселина. Макар те да имат подобни функционални групи, те не са хомолози, тъй като едното съединение има амино група, а другото не.
Г) Имаме два алдехида. И двете съединения са алдехиди и имат еднакъв брой въглеродни атоми в основната верига. Разликата между тях е един въглероден атом в страничната верига, което ги прави хомолози.
Следователно, двойката съединения, които са хомолози, са алдехидите в Г).
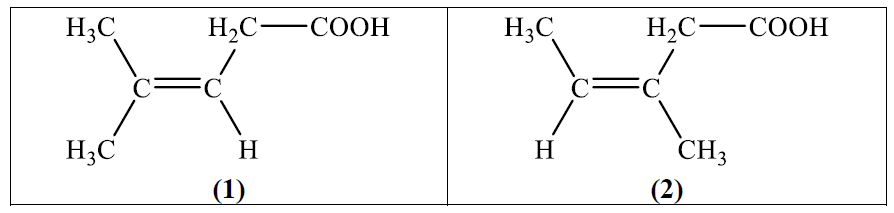
А) позиционни
Б) верижниВ) E,Z-изомериГ) енантиомери
РЕШЕНИЕ:
еществата (1) и (2) представляват верижни изомери. Верижните изомери са съединения със същата молекулна формула, но с различно разпределение на въглеродния скелет. Това се дължи на различното подреждане на въглеродните вериги и позиционното разположение на функционалните групи върху тази верига.
В случая с (1) и (2), имаме различно разположение на метилните групи и карбоксилната група върху въглеродната верига на алкеновата структура, което прави тези съединения верижни изомери.
Отговорът Б) „верижни“ е правилен.
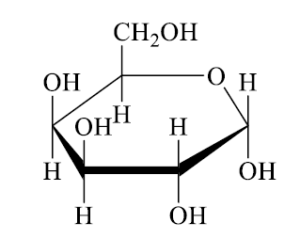
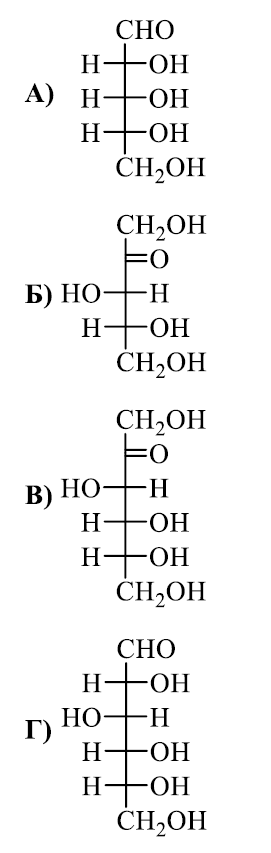
Представител на кой клас съединения е веществото А?
А) мазнини
Б) монозахаридиВ) полизахаридиГ) полихидроксикетони
РЕШЕНИЕ:
Съединението на изображението има шестчленен пръстен с хидроксилни групи (-OH), прикрепени към въглеродните атоми, което е характерно за захарите като глюкозата.
Мазнините са естери, съставени от мастни киселини и глицерол, и не образуват пръстеновидни структури като показаната. Полизахаридите са дълги вериги от монозахаридни единици, и полихидроксикетоните обикновено не формират пръстеновидни структури като монозахаридите.
Правилният отговор е Б) монозахариди.
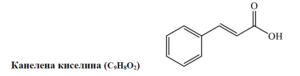
В кое от описаните взаимодействия на канелената киселина НЕ участва карбоксилната група?А) с натриева основаБ) с фосфорен пентахлоридВ) с етанол в кисела среда при нагряване
Г) с бром в тетрахлорометан
РЕШЕНИЕ:
Канелената киселина е органично съединение с молекулна формула C9H8O2, което съдържа както алкенова (винилова) група, така и карбоксилна група. В контекста на химическите реакции:
- А) С натриева основа – тук карбоксилната група ще реагира, за да образува карбоксилатен анион.
- Б) С фосфорен пентахлорид (PCl5) – карбоксилната група ще реагира, образувайки ацил хлорид.
- В) С етанол в кисела среда при нагряване – карбоксилната група ще реагира с етанола, образувайки естер в процес на естерификация.
- Г) С бром в тетрахлорометан – това е реакция, при която участва двойната връзка на алкеновата група в канелената киселина, където бромът може да се присъедини през адиция към въглеродните атоми на двойната връзка.
Така от посочените опции, в реакцията, която НЕ включва участието на карбоксилната група, е Г) с бром в тетрахлорометан.
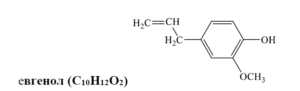
Прибавянето на кой реактив и каква промяна е указание за наличие на евгенол в дадена проба?А) Cu(OH)2 (без нагряване) – тъмносиньо оцветяванеБ) [Ag(NH3)2]OH (след нагряване) – отделя се сребро
В) разтвор на Br2 в CCl4 – обезцветяване на разтвораГ) разтвор на I2 и NaOH (след нагряване) – жълта утайка
РЕШЕНИЕ:
Евгенолът е фенолно съединение и е известен със своята способност да участва в реакции, които са характерни за фенолите и алкените поради наличието на хидроксилна група и ненаситена винилова група в структурата си. Описаните реакции във въпроса са:
А) Реакция с Cu(OH)2 – Тази реакция е типична за много прости захари, които при добавяне на меден(II) хидроксид без нагряване образуват тъмносин комплекс. Това не е характерно за евгенола.
Б) [Ag(NH3)2]OH (след нагряване) – Това е реакция на Tollens, използвана за доказване на алдехидни групи, където реактивът окислява алдехидите до карбоксилни киселини и се отделя сребро. Тази реакция също не е характерна за евгенола, тъй като той не съдържа алдехидна група.
В) Разтвор на Br2 в CCl4 – Това е реакция, при която бромът реагира с алкени чрез механизъм на адиция, където двойната връзка реагира и консумира брома, като по този начин обезцветява разтвора. Това е характерна реакция за евгенола, поради наличието на ненаситената винилова група.
Г) Разтвор на I2 и NaOH (след нагряване) – Това е характерно за реакцията на фенолите с иод в алкална среда, известна като реакцията на Либерман, която води до образуването на жълта утайка.
От всички посочени опции, реактивът, който и промяната, която е указание за наличие на евгенол в дадена проба, е:
В) разтвор на Br2 в CCl4 – обезцветяване на разтвора, тъй като това показва наличието на винилова група в евгенола, която участва в адиционна реакция с брома.
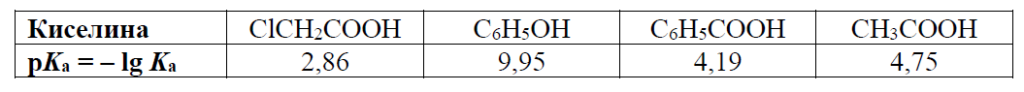
А) ClCH2COOHБ) CH3COOHВ) C6H5COOHГ) C6H5OH
РЕШЕНИЕ:
Силата на киселините може да бъде оценена чрез техните pKa стойности. Колкото по-ниска е стойността на pKa, толкова по-силна е киселината. Това е така, защото pKa е отрицателният логаритъм (по основа 10) на константата на киселинност (Ka), което означава, че по-високата Ka кореспондира на по-ниска стойност на pKa.
На база на предоставената таблица:
- ClCH2COOH има pKa = 2.86
- CH3COOH има pKa = 4.75
- C6H5COOH има pKa = 4.19
- C6H5OH има pKa = 9.95
От тези стойности, най-ниската pKa стойност е за ClCH2COOH, което показва, че това е най-силната киселина от предложените варианти.
Така отговорът е А) ClCH2COOH.
А) 1,10.10-5Б) 2,20.10-5
В) 1,21.10-10Г) 1,21.10-25
РЕШЕНИЕ:
Произведението на разтворимост (Ksp) е мярка за разтворимостта на трудноразтворими соли и се изчислява като произведението от концентрациите на йоните, умножени по техните стехиометрични коефициенти.
За BaCrO4, разлагането му във воден разтвор може да бъде изразено чрез уравнението:
BaCrO4 (твърдо) ⇌ Ba²⁺ (воден) + CrO₄²⁻ (воден)
Ksp = [Ba²⁺][CrO₄²⁻]
Тъй като BaCrO4 се разлага на 1 мол Ba²⁺ и 1 мол CrO₄²⁻ за всеки мол разтворена сол, концентрациите на Ba²⁺ и CrO₄²⁻ в наситен разтвор са равни на разтворимостта на BaCrO4, която е 1,1 x 10⁻⁵ M.
Така Ksp за BaCrO4 ще бъде:
Ksp = (1,1 x 10⁻⁵)(1,1 x 10⁻⁵) = 1,21 x 10⁻¹⁰
Отговорът е В) 1,21.10⁻¹⁰.
А) по оцветяване на виолетовия лакмус в червено във водния разтворБ) образуване на бяла утайка при добавяне на разтвор на сребърен нитратВ) образуване на бяла утайка при добавяне на разтвор на оловен динитрат
Г) образуване на черна утайка при пропускане на сероводород през разтвора
РЕШЕНИЕ:
Добавянето на сероводород (H2S) във водни разтвори на метални йони е често използван метод за тяхното откриване чрез образуване на трудноразтворими сулфиди. В случая с медните йони (Cu²⁺), добавянето на H2S обикновено води до образуването на черен осадък от меден сулфид (CuS), докато цинковите йони (Zn²⁺) образуват бял осадък от цинков сулфид (ZnS). Ето защо добавянето на сероводород е добър начин да се различи медния дихлорид от цинковия дихлорид.
От опциите, Г) образуване на черна утайка при пропускане на сероводород през разтвора е верният отговор, който показва наличието на Cu²⁺ йони в епруветка 1.
А) 1
Б) 3В) 7Г) 11
РЕШЕНИЕ:
За да определим pH на 1.10^-3 M разтвор на солна киселина (HCl), която е силна киселина и се дисоциира напълно във воден разтвор, можем да използваме формулата за pH:
𝑝𝐻=−log[𝐻+]pH=−log[H+]
Концентрацията на хидрониевите йони (H⁺) в разтвора на HCl ще бъде равна на моларната концентрация на HCl, тъй като тя се дисоциира напълно:
[𝐻+]=1.10−3 M[H+]=1.10−3 M
Замествайки тази стойност във формулата за pH, получаваме:
𝑝𝐻=−log(1.10−3)pH=−log(1.10−3)
Това дава стойност на pH, която е приблизително равна на 3. Следователно, pH-метърът в разтвора на солна киселина с концентрация 1.10^-3 M ще покаже стойност около 3.
Отговорът е Б) 3.
Решения на Втори Модул
ОЧАКВАЙТЕ СКОРО!