РЕШЕНИЯ ДЗИ химия 21.052021
В хармониката по-долу ще намерите верните отговори и подробни решения на въпросите от матурата по Химия от 21 май 2021. Кликнете върху задачата и ще се отворят опциите с означен в зелено верния и подробно решение обосноваващо отговора
Използвайте решенията при неясноти или за идеи как да изградите стратегията си за решаване на матурата. Към всеки въпрос може да подходите по различен начин, в зависимост от къде решите да тръгнете. Ние сме използвали най-различни методи – от разнищване на условието до подробно разглеждане на всяка една възможност и изключване една по една до достигане на верния отговор.
Решения на Първи Модул
За да определим правилния отговор на този въпрос, нека първо да анализираме информацията, предоставена във въпроса:
- Елементът се намира в трети период на Периодичната таблица.
- Има два електрона във външния електронен слой на атомите си.
Третият период на Периодичната таблица включва следните елементи: Натрий (Na), Магнезий (Mg), Алуминий (Al), Силиций (Si), Фосфор (P), Сяра (S), Хлор (Cl) и Аргон (Ar). Сред тези елементи, само магнезия (Mg) има два електрона във външния си електронен слой.
Магнезият е метал и като такъв, когато реагира с кислород, образува основен оксид (MgO). Така че, този елемент показва метални свойства и формира основен оксид.
Следователно, правилният отговор на въпроса е:
А) метал и образува основен оксид
А) S и KБ) F2 и Na
В) Cl2 и H2Г) O2 и Mg
РЕШЕНИЕ:
За да определим кое от предложените взаимодействия води до образуването на химично съединение с ковалентни химични връзки, нека разгледаме характеристиките на всяко вещество и естеството на възможната връзка между тях:
А) S (сяра) и K (калий) – Серата е неметал, а калият е метал. Тяхното взаимодействие обикновено води до образуването на йонни съединения, тъй като металите отдават електрони, а неметалите ги приемат. Така се образува йонно съединение (K₂S), а не ковалентно.
Б) F₂ (флуор) и Na (натрий) – Флуорът е силно реактивен неметал, а натрият е метал. Те също формират йонни съединения, където натрият отдава електрони, които флуорът приема, водейки до образуването на натриев флуорид (NaF).
В) Cl₂ (хлор) и H₂ (водород) – И двата елемента са неметали и могат да образуват ковалентни съединения чрез споделяне на електрони. При тяхното взаимодействие се образува хлороводород (HCl), който е ковалентно съединение.
Г) O₂ (кислород) и Mg (магнезий) – Кислородът е неметал, докато магнезият е метал. Техното взаимодействие води до образуването на магнезиев оксид (MgO), който е йонно съединение, тъй като магнезият отдава електрони към кислорода.
Следователно, правилният отговор на въпроса е:
В) Cl₂ и H₂ – тези две вещества взаимодействат, за да образуват химично съединение с ковалентни химични връзки.
А) N₂
Б) I₂В) MgГ) CaF₂
РЕШЕНИЕ:
За да определим кое от изброените вещества е твърдо вещество с молекулна кристална решетка при стандартни условия (около 20 °C и 1 атм), разглеждаме физическите свойства и вида на химичната връзка във всяко от тях:
А) N₂ (азот) – При стандартни условия азотът е газ, състоящ се от молекули N₂, така че той не отговаря на условието да бъде твърдо вещество с молекулна кристална решетка.
Б) I₂ (йод) – Йодът е пример за твърдо вещество с молекулна кристална решетка при стандартни условия. Молекулите I₂ взаимодействат чрез слаби междумолекулни сили (например Ван дер Ваалсови сили), образувайки кристали.
В) Mg (магнезий) – Магнезият е метал и при стандартни условия формира метална кристална решетка, където атомите са подредени в плътно опакована структура, а не молекулна.
Г) CaF₂ (калциев флуорид) – Калциевият флуорид е пример за йонно съединение, което при стандартни условия също формира твърдо вещество, но с йонна кристална решетка, където калциевите и флуоридните йони са разположени в редовна структура, а не молекулна.
Следователно, веществото, което е твърдо вещество с молекулна кристална решетка при обикновени условия, е:
Б) I₂ (йод)
А) В1Б) В2В) В3
Г) В4
РЕШЕНИЕ:
Електропроводимостта на вещество зависи от наличието и подвижността на свободни зарядоносители като електрони или йони. Нека разгледаме всеки от четирите случая:
А) В1 – вещество, изградено от неполярни молекули. Неполярните молекули не образуват свободни зарядоносители в твърда фаза, поради което това вещество ще има много ниска или никаква електропроводимост.
Б) В2 – вещество, изградено от полярни молекули. Въпреки че полярните молекули имат вътрешно разделени положителни и отрицателни краища, в твърда фаза те също обикновено не предоставят свободни зарядоносители за провеждане на електричество.
В) В3 – вещество с йонна кристална решетка. Йонните съединения могат да провеждат електричество в разтопено състояние или в разтвор, където йоните са свободни да се движат. В твърда фаза обаче йоните са фиксирани в решетката и не могат лесно да се движат, което ограничава електропроводимостта.
Г) В4 – вещество с метална кристална решетка. Металите са добри проводници на електричество, тъй като те имат „море“ от свободни електрони, които могат лесно да се движат през кристалната решетка, провеждайки електрически ток.
Следователно, можем да заключим, че веществото с най-висока електропроводимост е това с метална кристална решетка:
Г) В4
А) HClБ) N₂OВ) CaOГ) Na₂S
РЕШЕНИЕ:
Степента на окисление (или оксидационното състояние) показва хипотетичния заряд на атома, ако всички връзки са йонни. Нека разгледаме всеки от предложените варианти:
А) HCl (хлороводород) – Водородът обикновено има степен на окисление +1, докато хлорът в това съединение има степен на окисление –1, тъй като приема електрон от водорода.
Б) N₂O (диазотен оксид) – В това съединение азотът и кислородът имат различни степени на окисление, но степента на окисление на кислорода е почти винаги –2 в повечето химични съединения, което означава, че азотът няма как да е със степен на окисление –1.
В) CaO (калциев оксид) – В това съединение калцият има степен на окисление +2, докато кислородът има степен на окисление –2.
Г) Na₂S (натриев сулфид) – В този случай натрият има степен на окисление +1 (като алкален метал), а сярата има степен на окисление –2, за да се компенсират зарядите и да се образува неутрално съединение.
Следователно, единственото съединение, в което един от елементите има степен на окисление –1, е:
А) HCl
А) понижи температуратаБ) добави газообразен катализатор
В) намали концентрацията на продукта XZГ) намали концентрацията на веществото X или Z
РЕШЕНИЕ:
Скоростта на химична реакция може да бъде повлияна от множество фактори, включително температурата, наличието на катализатор, концентрацията на реагентите и продуктите. Нека разгледаме всяка от предложените опции:
А) Понижи температурата – Обикновено понижаването на температурата води до намаляване на скоростта на химичните реакции, тъй като молекулите се движат по-бавно и срещите между тях са по-рядко срещани.
Б) Добави газообразен катализатор – Катализаторите увеличават скоростта на химичните реакции, като предлагат алтернативен път с по-ниска активационна енергия. Така че, добавянето на катализатор ще промени скоростта на реакцията.
В) Намали концентрацията на продукта XZ – Според принципа на Льо Шателие, ако концентрацията на продуктите на реакцията намалее, системата ще се стреми да произведе повече продукт, за да възстанови равновесието. Въпреки това, за реакция, която не е в равновесие, намаляването на концентрацията на продукта може да не промени пряко скоростта на реакцията, ако реакцията вече е към формиране на продукта.
Г) Намали концентрацията на веществото X или Z – Според закона за действащите маси, скоростта на химичната реакция е пропорционална на концентрациите на реагентите. Така че, намаляването на концентрацията на един от реагентите (X или Z) обикновено води до намаляване на скоростта на реакцията.
Измежду предложените варианти, намаляването на концентрацията на продукта XZ (В) е сценарият, при който е най-вероятно скоростта на реакцията да не се промени значително, особено ако реакцията е далеч от равновесие и се стреми към продължаване към продукта.
8. В три чаши (1, 2 и 3) има солна киселина с еднаква концентрация, но с различен обем: в чаша 1 – 50 mL, в 2 –
100 mL, а в 3 – 150 mL. В чаши 1 и 2 се прибавят съответно по 1,0 g желязна пластинка и 1,0 g желязо на гранули, а в 3 – 0,5 g железен прах. С най-голяма скорост протича химичнареакция в чаша 3, защото:
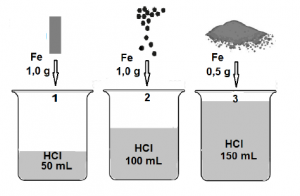
А) обемът на киселината е най-голямБ) количеството на желязото е най-малко
В) повърхността на желязото е най-голямаГ) количеството (mol) на водородните йони е най-голямо
РЕШЕНИЕ:
Химичната реакция между желязо (Fe) и солна киселина (HCl) е реакция на заместване, при която желязото измества водорода от киселината, образувайки желязен(II) хлорид (FeCl₂) и водороден газ (H₂). Скоростта на тази реакция зависи от няколко фактора, включително повърхността на реагиращите вещества, концентрацията и обема на реагентите, както и от тяхната форма и размер.
Ако разгледаме опциите:
А) Обемът на киселината е най-голям – Обемът на киселината влияе на общото количество на HCl, но при еднаква концентрация не е основният фактор, който определя скоростта на реакцията.
Б) Количеството на желязото е най-малко – По-малкото количество желязо означава, че ще има по-малко материал за реакция, но това не винаги означава, че реакцията ще протича с най-голяма скорост.
В) Повърхността на желязото е най-голяма – Когато реагиращото вещество има по-голяма повърхност, това позволява по-голямо взаимодействие с реагента (в случая HCl), което увеличава скоростта на реакцията. Железният прах има много по-голяма реактивна повърхност в сравнение с гранулите и пластинката, което го прави най-реактивен.
Г) Количеството (mol) на водородните йони е най-голямо – Тъй като концентрацията на HCl е еднаква във всички чаши, молярното количество на водородните йони е пряко пропорционално на обема на киселината. Въпреки това, това не е пряка причина за увеличение на скоростта на реакцията, тъй като водородните йони са достатъчни във всеки случай за реакцията с желязото.
Следователно, най-вероятната причина за най-високата скорост на реакция в чаша 3 е:
В) Повърхността на желязото е най-голяма.
А) Внася фина желязна тел в съд, пълен с хлор – желязото изгаря.Б) Поставя във вода късче калий – появява се виолетов пламък.
В) Смесва оцетна киселина и сода за хляб в чаша с термометър – температурата се понижава.Г) Към отвора на епруветка, пълна с водород и кислород, поднася запалена клечка – чува се силен звук.
РЕШЕНИЕ:
Ендотермичните реакции са тези, при които се абсорбира топлина от околната среда, докато при екзотермичните реакции се отделя топлина. Ето анализ на четирите опции:
А) Внася фина желязна тел в съд, пълен с хлор – желязото изгаря. Това е екзотермичен процес, при който се отделя топлина.
Б) Поставя във вода късче калий – появява се виолетов пламък. Реакцията на калия с водата е силно екзотермична и също отделя топлина, както и водороден газ, който може да запали.
В) Смесва оцетна киселина и сода за хляб в чаша с термометър – температурата се понижава. Това е ендотермичен процес, при който системата абсорбира топлина от околната среда, което води до понижаване на температурата.
Г) Към отвора на епруветка, пълна с водород и кислород, поднася запалена клечка – чува се силен звук. При този опит протича екзотермична реакция на съединение, при която се отделя много топлина и се чува силен звук поради експлозията.
Следователно, ендотермичен процес протича при опита, описан в отговор В) Смесва оцетна киселина и сода за хляб в чаша с термометър – температурата се понижава.
А) добави катализаторБ) понижи наляганетоВ) повиши температурата
Г) внeсе допълнително О2
РЕШЕНИЕ:
За да определим какъв ефект биха имали различните действия върху равновесната концентрация на NO2 в равновесната система, е необходимо да разгледаме принципа на Льо Шателие. Той гласи, че ако върху система в химично равновесие се окаже външно въздействие (като промяна в концентрацията, налягането, температурата или добавянето на катализатор), равновесието ще се измести в посока, която да компенсира това въздействие.
А) Добави катализатор – Катализаторите ускоряват както пряката, така и обратната реакция, но не променят равновесните концентрации на реагентите и продуктите. Те просто помагат системата да достигне равновесие по-бързо.
Б) Понижи налягането – Според принципа на Льо Шателие, ако налягането се понижи, равновесието ще се измести в посока, която произвежда повече газови молекули. В този случай, тъй като пряката реакция води до образуване на същия брой молекули от двете страни (2 молекули NO и 1 молекула O2 реагират за да образуват 2 молекули NO2), промяната на налягането не трябва да има значителен ефект върху равновесната концентрация на NO2.
В) Повиши температурата – Тъй като реакцията за образуване на NO2 е екзотермична (отделя топлина), увеличаването на температурата ще предизвика изместване на равновесието в посока на обратната реакция (т.е. разграждане на NO2 обратно към NO и O2), за да се абсорбира излишната топлина. Така концентрацията на NO2 би намаляла, а не увеличила.
Г) Внeсе допълнително O2 – Ако се добави допълнителен кислород, съгласно принципа на Льо Шателие равновесието ще се измести в посока, която потребява добавения кислород. Това ще стимулира пряката реакция, като увеличи образуването на NO2.
Измежду предложените варианти, единственият, който ще доведе до увеличаване на равновесната концентрация на NO2, е:
Г) Внeсе допълнително O2
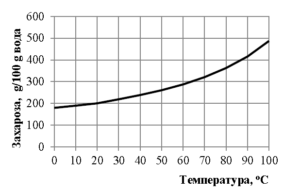
А) наситен с утайкаБ) ненаситен с утайкаВ) наситен без утайка
Г) ненаситен без утайка
РЕШЕНИЕ:
Графиката показва разтворимостта на захарозата във вода в зависимост от температурата. Разтворимостта е максималното количество вещество, което може да се разтвори в определено количество разтворител (в този случай вода) при дадена температура, за да се образува наситен разтвор.
Ако при 20 °C в 100 g вода се разтварят 200 g захароза и според графиката разтворимостта на захарозата се увеличава с повишаването на температурата, тогава при загряване до 90 °C разтворът ще може да разтвори още повече захароза от първоначално разтворените 200 g.
Така ако при 90 °C разтворимостта е по-голяма от 200 g захароза на 100 g вода тогава текущият разтвор от 200 g захароза в 100 g вода ще бъде ненаситен, тъй като ще може да се разтвори още захароза при тази температура. Няма да има утайка, защото веществото е напълно разтворено в разтвора.
В резултат, при загряване до 90 °C, според описаната графика, ще се получи:
Г) ненаситен без утайка – ако при тази температура разтворимостта е по-голяма от 200 g захароза на 100 g вода.
А) плътността на разтвора е по-малка от 1 g/cm3Б) плътността на разтвора е равна на плътността на водатаВ) съдържа толкова сол, колкото е разтворимостта ѝ за дадената температура
Г) съдържа по-малко сол, отколкото е разтворимостта ѝ за дадената температура
РЕШЕНИЕ:
Разтворимостта на вещество е максималното количество от това вещество, което може да се разтвори в дадено количество разтворител при определена температура, за да се образува наситен разтвор. Наситен разтвор съдържа колкото се може повече разтворено вещество при дадените условия, като всяко допълнително количество от това вещество няма да се разтвори и ще остане като утайка. От друга страна, ненаситен разтвор е такъв, в който се съдържа по-малко разтворено вещество, отколкото е възможно при дадените условия.
По този начин, правилният отговор за това кога разтвор на NaCl е ненаситен е:
Г) съдържа по-малко сол, отколкото е разтворимостта ѝ за дадената температура.
А) 0,05 gБ) 0,1 g
В) 1,0 gГ) 5,0 g
РЕШЕНИЕ:
Масовата част на йода в йодната тинктура е 5%, което означава, че в 100 грама йодна тинктура има 5 грама йод. За да намерим колко грама йод има в 20 грама йодна тинктура, можем да използваме пропорционалност: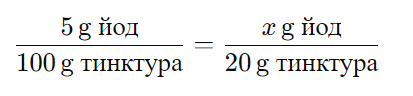
Където x е масата на йода в 20 грама тинктура. Решавайки за x, получаваме:
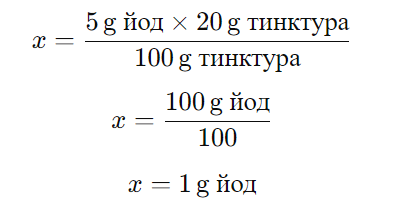
Така че в една опаковка с 20 грама йодна тинктура се съдържа 1 грам йод, което съответства на отговор:
В) 1,0 g
А) водата се изпарява заедно с кислорода
Б) разтварянето на кислорода е екзотермичен процесВ) разтварянето на кислорода е ендотермичен процесГ) през лятото водните организми се нуждаят от по-малко кислород
РЕШЕНИЕ:
Разтворимостта на газовете в течности като вода обикновено намалява с повишаване на температурата. Когато температурата на водата се увеличи, кинетичната енергия на молекулите се увеличава, което води до намалена способност на водата да задържа газове в разтвор.
А) Водата се изпарява заедно с кислорода – Водата се изпарява, но кислородът не се изпарява заедно с нея в значителни количества.
Б) Разтварянето на кислорода е екзотермичен процес – Това е верният отговор. Като екзотермичен процес, разтварянето на кислорода във водата отделя топлина. С увеличаване на температурата, съгласно принципа на Льо Шателие, равновесието ще се измести в обратна посока, което води до намаляване на разтворен кислород.
В) Разтварянето на кислорода е ендотермичен процес – Ако разтварянето беше ендотермичен процес, разтворимостта би се увеличила с повишаване на температурата, което е противоположното на наблюдавания феномен.
Г) През лятото водните организми се нуждаят от по-малко кислород – В действителност, през лятото метаболитните процеси често се ускоряват поради повишената температура, което би увеличило нуждата от кислород.
Така че верният отговор е:
Б) Разтварянето на кислорода е екзотермичен процес.
А) Т(Н2О) < Т1 < Т2
Б) Т(Н2О) < Т2 < Т1В) Т2 < Т(Н2О) < Т1Г) Т1 < Т2 < Т(Н2О)
РЕШЕНИЕ:
Когато в вода се разтвори вещество, температурата на кипене на разтвора се повишава в сравнение с чистата вода поради явлението, известно като ефект на ебулиоскопия. Температурата на кипене се повишава, тъй като частиците на разтвореното вещество намаляват вапоризацията на водата, като по този начин се изисква повече енергия (или по-висока температура) за кипене.
Ако разтвор 1 е по-концентриран от разтвор 2, тогава той ще има по-висока температура на кипене от разтвор 2. Чистата вода ще има най-ниската температура на кипене, защото липсата на разтворено вещество означава, че няма ефект на ебулиоскопия.
Следователно, температурите на кипене нарастват в следния ред:
Т(Н2О) < Т2 < Т1
където Т(Н2О) е температурата на кипене на чистата вода, Т2 е температурата на кипене на по-разредения разтвор, и Т1 е температурата на кипене на по-концентрирания разтвор.
Отговорът е:
Б) Т(Н2О) < Т2 < Т1
А) фенол и на сярна киселинаБ) сярна киселина
В) захарозаГ) фенол
РЕШЕНИЕ:
pH стойността на разтвор измерва неговата киселинност или алкалност, където ниски pH стойности (от 0 до 7) сочат киселинен разтвор, а високи pH стойности (от 7 до 14) сочат алкален разтвор. На pH 7 разтворът е неутрален.
Сярната киселина (H2SO4) е силна киселина и когато се разтвори във вода, ще има ниска pH стойност.
Фенолът (C6H5OH) е слаба киселина и ще има по-висока pH стойност от тази на сярната киселина, но все пак киселинна (по-малко от 7).
Захарозата (C12H22O11) е захар и при разтваряне във вода няма да променя значително pH стойността, така че рН на разтвора ще остане близо до неутралното ниво на чистата вода, което е около 7.
Следователно, разтворът на захарозата ще има най-високата pH стойност, тъй като тя няма да допринесе за киселинността на разтвора, както правят фенолът и сярната киселина.
Отговорът е:
В) захароза
А) азотен нитрат
Б) амониев нитратВ) амонячен нитратГ) тетраамониев тринитрат
РЕШЕНИЕ:
Химичната формула NH4NO3 представлява солта, известна като амониев нитрат. Тя се състои от амониевия катион (NH4+) и нитратния анион (NO3−). Това е широко използван тор в земеделието поради високото съдържание на азот, който е важен за растежа на растенията.
Отговорът е:
Б) амониев нитрат
А) Pb2+ + NO3⁻ + K⁺ + I2 → PbI2 + K+ + NO3⁻Б) 2Pb2+ + NO3⁻ + K⁺ +2I⁻ → PbI2 + K+ + NO3⁻В) Pb2+ + (NO3⁻ )2 + K⁺ + I2⁻ → PbI2 + K+ + NO3⁻
Г) Pb2+ + 2NO3⁻ + 2K⁺ + 2I⁻ → PbI2 + 2K+ + 2NO3⁻
РЕШЕНИЕ:
Йонните уравнения изразяват реакциите между йоните в разтвор. Когато се смесват водни разтвори на оловен динитрат (��(��3)2Pb(NO3)2) и калиев йодид (��KI), оловният йон (��2+Pb2+) реагира с йодидния йон (�−I−), за да образува утайка от оловен йодид (���2PbI2), докато нитратният йон (��3−NO3−) и калиевият йон (�+K+) остават в разтвора като спектаторни йони и не участват пряко в реакцията.
Точното йонно уравнение за реакцията е:
��2++2�−→���2Pb2++2I−→PbI2
Въз основа на предложените варианти, коректното уравнение е това, което правилно показва балансираните заряди и което не включва спектаторните йони. Опцията, която най-добре отразява тези условия е:
Г) ��2++2��3−+2�++2�−→���2+2�++2��3−Pb2++2NO3−+2K++2I−→PbI2+2K++2NO3−
Този вариант показва правилно балансирани заряди и включва всички йони, участващи в реакцията, както и тези, които остават неизменни в разтвора (калиевите и нитратните йони). Утайката на оловен йодид е показана, и спектаторните йони са включени от двете страни на уравнението.
А) Al + H2SO4 → AlSO4 + H2Б) Al + 2H2SO4 → Al(SO4)2 + 2H2
В) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2Г) 3Al + 2H2SO4 → Al3(SO4)2 + 2H2
РЕШЕИЕ:,
Реакцията между алуминий (Al) и сярна киселина (H2SO4) е реакция на заместване, където алуминият измества водорода от киселината и се образуват алуминиев сулфат (Al2(SO4)3) и водороден газ (H2). Уравнението на реакцията трябва да бъде балансирано както по атоми, така и по електрически заряди.
Балансираното химично уравнение на този процес е:
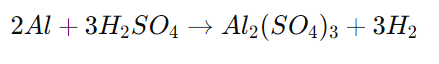
Тук алуминият (Al) е с валентност 3+, и затова за да образува съединение със сулфатния анион (SO4)2-, който е с валентност 2-, е необходимо два атома алуминий за три молекули сярна киселина, за да се получи балансирано съединение. Резултатът е една формула единица алуминиев сулфат и три молекули водороден газ.
Следователно, верният отговор е:
В) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
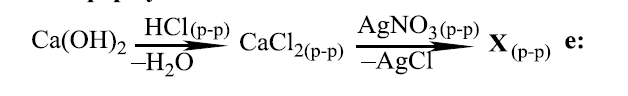
А) CaClБ) CaNO3
В) Ca(NO3)2Г) Ca(OH)NO3
РЕШЕНИЕ:
Схемата показва серия от химични реакции, при които калциевият хидроксид реагира със солна киселина (HCl) за образуване на калциев хлорид (CaCl2) и вода (H2O), след което калциевият хлорид реагира със сребърен нитрат (AgNO3) за да се получи сребърен хлорид (AgCl) и веществото X.
От реакцията между CaCl2 и AgNO3, ионите хлор (Cl-) реагират със сребърните йони (Ag+) за образуването на AgCl, оставяйки калциевите йони (Ca2+) в разтвора. Тъй като за всеки Ag+ йон се изисква по един нитратен йон (NO3-) за баланс на заряда, и приполагайки, че реакцията протича до завършване, в крайния разтвор ще остане калциев нитрат.
Калциевият нитрат има формула Ca(NO3)2, като калциевият йон със заряд +2 балансира двата нитратни йона, всеки със заряд -1.
Следователно, химичната формула на веществото X в схемата е:
В) Ca(NO3)2
А) азотният оксидБ) амонякътВ) нитрититеГ) нитратите
РЕШЕНИЕ:
Азотният оксид (NO) е газ, който се формира при високи температури в двигатели с вътрешно горене и при някои други индустриални процеси. След излизане в атмосферата, той може да реагира с кислорода за образуване на азотен диоксид (NO2), който е основен компонент на фотохимичния смог. Азотният диоксид може да реагира с водните пари в атмосферата за образуването на нитрати или да участва в други реакции, допринасящи за смога.
Амонякът (NH3), нитритите (NO2-) и нитратите (NO3-) също са част от кръговрата на азота, но обикновено не са пряко свързани с образуването на смога в градската атмосфера в същата степен както азотните оксиди.
Следователно, съединението, което при определени климатични условия може да причини смог в големите градове, е:
А) азотният оксид
А) бронз
Б) чугунВ) месингГ) стомана
РЕШЕНИЕ:
Желязо-въглеродна сплав със съдържание на въглерод от 2% до 5% се класифицира като чугун. Чугунът е известен с високото си съдържание на въглерод, което му придава характеристичните свойства като леярна способност и издръжливост, но го прави и по-склонен към крехкост в сравнение със стоманата, която обикновено съдържа по-малко въглерод (под 2%).
Бронзът е сплав на мед и олово или калай, месингът е сплав на мед и цинк, а стоманата е желязо-въглеродна сплав с по-ниско съдържание на въглерод от чугуна.
Следователно, правилният отговор е:
Б) чугун
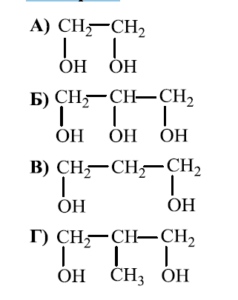
РЕШЕНИЕ:
Глицеролът е известен с химичната си структура, която е трихидроксипропан, тоест има три хидроксилни (OH) групи, свързани с пропанова основа. Вариантите, предоставени във файла, показват различни органични съединения. Търсим съединение с три карбонови атома, всеки от които е свързан с по една хидроксилна група.
Вариантът, който отговаря на това описание, е:
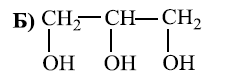
Това е молекулата на глицерола (или глицерин), която има три въглеродни атома и по една хидроксилна група свързана към всеки от тях.
А) 1-бутен и 2-бутенБ) пропанал и пропанонВ) 2-метилпропан и бутан
Г) метанова киселина и етанова киселина
РЕШЕНИЕ:
Хомолози са съединения, които принадлежат към една и съща хомологична поредица и се различават едно от друго със стъпка ��2CH2. Те имат подобни химични свойства заради сходната си функционална група.
Анализираме всяко съединение в предложените варианти:
А) 1-бутен и 2-бутен не са хомолози, защото и двете съединения са алкени с четири въглеродни атома и се различават само по позицията на двойната връзка.
Б) Пропанал и пропанон не са хомолози, тъй като и двете са тривъглеродни съединения, но с различни функционални групи (алдехидна и кетонова съответно), което ги прави функционални изомери, а не хомолози.
В) 2-метилпропан и бутан също не са хомолози, въпреки че и двете са алкани с общ брой въглеродни атоми. Те са изомери с различна структура на веригата.
Г) Метанова киселина и етанова киселина са хомолози. Те са част от хомологичната поредица на карбоксилните киселини, като метановата киселина има един въглероден атом, а етановата киселина има два. Етановата киселина има една ��2CH2 група повече от метановата киселина. Структурните им формули са:
- Метанова киселина (формиева киселина): �����HCOOH
- Етанова киселина (оцетна киселина): ��3����CH3COOH
Следователно, правилният отговор, показващ хомолози, е: Г) Метанова киселина и етанова киселина
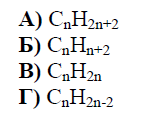
РЕШЕНИЕ:
Бутенът е ненаситен въглеводород с обща формула ���2�CnH2n, което е характерно за алкените – хомологичен ред на въглеводородите с една двойна връзка между въглеродните атоми. Алкените имат два водорода по-малко от кореспондиращите алкани (съединения със само единични връзки), които имат формула ���2�+2CnH2n+2.
От предложените варианти:
А) ���2�+2CnH2n+2 е формулата за алкани. Б) ����+2CnHn+2 не представлява обичайната формула на никой хомологичен ред на въглеводородите. В) ���2�CnH2n е формулата за алкени. Г) ���2�−2CnH2n−2 е формулата за алкарии (въглеводороди с две двойни връзки) или за алкини (с една тройна връзка).
Правилният отговор, отразяващ хомологичния ред на бутена, е:
В) ���2�CnH2n
А) ацетон – кетони
Б) етанол – фенолиВ) етанал – алдехидиГ) аминооцетна киселина – аминокиселини
РЕШЕНИЕ:
Класът съединения, към който принадлежи едно органично съединение, определя неговите функционални групи и свойства. Нека разгледаме всяко съединение и класа, към който принадлежи:
А) ацетон – кетони – Ацетонът е най-простият кетон и е представител на този клас съединения. Има структурна формула ��3����3CH3COCH3, където карбонилната група (=O) е свързана с два въглеродни атома.
Б) етанол – феноли – Етанолът е алкохол, а не фенол. Фенолите са ароматни съединения, които имат хидроксилна група, свързана директно с ароматен пръстен, докато етанолът има хидроксилна група, свързана с алкилна верига (��3��2��CH3CH2OH). Това е съединението, което не съответства на изброения клас.
В) етанал – алдехиди – Етаналът е алдехид с химична формула ��3���CH3CHO, където карбонилната група (=O) е свързана с въглероден атом, който е на края на веригата.
Г) аминооцетна киселина – аминокиселини – Аминооцетната киселина, известна още като глицин, е аминокиселина. Тя съдържа амино група (-NH2) и карбоксилна група (-COOH), които са характерни за аминокиселините.
Следователно, редът, който няма съответствие между наименованието на съединението и класа съединения, към който принадлежи, е:
Б) етанол – феноли
А) белтък
Б) захарозаВ) амилозаГ) целулоза
РЕШЕНИЕ:
Природните полимери са големи молекули, съставени от многократно повтарящи се малки единици, наречени мономери, свързани чрез ковалентни връзки. Те са широко разпространени в живата природа и имат различни функции.
А) белтък – Белтъците (или протеините) са полимери, чиито мономери са аминокиселини.
Б) захароза – Захарозата е дизахарид, съставен от две монозахаридни единици – глюкоза и фруктоза, и не е полимер.
В) амилоза – Амилозата е един от двата компонента на скорбялата, която е природен полимер. Мономерните единици на амилозата са молекули глюкоза, свързани в дълги линейни вериги.
Г) целулоза – Целулозата е природен полимер, съставен от дълги вериги от глюкозни единици, който формира структурната компонента на растителните клетъчни стени.
Следователно, веществото, което не се отнася към природните полимери, е:
Б) захароза
А) 2CH3OH → CH3OCH3 + H2OБ) C6H5ОH + КOH → C6H5ОK + H2OВ) CH3COOH + NaOH → CH3COONa + H2O
Г) CH3COOH + CH3OH → CH3COOCH3 + H2O
РЕШЕНИЕ:
Естерификация е химична реакция между киселина и алкохол, при която се образува естер и вода. Реакцията се катализира от киселина и обикновено се извършва при нагряване. Разгледайки предложените уравнения:
А) 2CH3OH → CH3OCH3 + H2O – Това уравнение представлява реакция на дехидратация на метанол, в резултат на което се образува диметилов етер, а не естер.
Б) C6H5OH + KOH → C6H5OK + H2O – Тук имаме пример за реакция на натриев фенолат, която е неутрализация, а не естерификация.
В) CH3COOH + NaOH → CH3COONa + H2O – Това е неутрализационна реакция между уксусна киселина и натриев хидроксид, като резултатът е образуването на натриев ацетат и вода, не е естерификация.
Г) CH3COOH + CH3OH → CH3COOCH3 + H2O – Това уравнение изразява естерификация. Оцетната киселина (CH3COOH) реагира с метанола (CH3OH), като образува метил ацетат (CH3COOCH3) и вода.
Следователно, уравнението, което изразява естерификация, е:
Г) CH3COOH + CH3OH → CH3COOCH3 + H2O
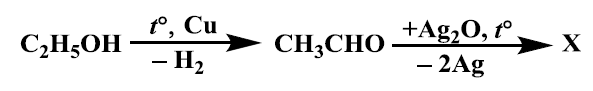
А) CH3OH
Б) CH3COOHВ) CH3COCH3Г) CH3CH2COOH
РЕШЕНИЕ:
На схемата е показан процес на окисление на етанол (C2H5OH) до ацеталдехид (CH3CHO) с помощта на катализатор на базата на мед (Cu), последвано от още една реакция, при която ацеталдехидът реагира със сребърен оксид (Ag2O), като се отделят атоми сребро (Ag) и се образува веществото X.
Сребърният оксид е окислител, който обикновено се използва за превръщане на алдехиди в съответните карбонови киселини чрез окислително дехидриране. В случая с ацеталдехида, той би бил превърнат в уксусна киселина (CH3COOH).
Следователно, X в схемата е оцетна киселина, и правилният отговор е:
Б) CH3COOH
А) мазнини с готварска солБ) яйчен белтък с готварска сол
В) мазнини със сода каустикГ) яйчен белтък със сода каустик
РЕШЕНИЕ:
Сапунът се получава чрез процес, наречен сапунене, който включва реакция на мазнини (като животни мазнини или растителни масла) с алкали, най-често сода каустик (натриев хидроксид, NaOH). Този процес превръща мазнините в соли на мастни киселини и глицерол, които са основните компоненти на сапуна.
А) мазнини с готварска сол – Готварската сол сама по себе си не може да сапуниса мазнините.
Б) яйчен белтък с готварска сол – Яйчен белтък е богат на протеини и не може да се използва за производството на сапун.
В) мазнини със сода каустик – Това е верният отговор. Когато мазнините се загреят със сода каустик (натриев хидроксид), протича сапунене, при което мазнините се превръщат в сапун.
Г) яйчен белтък със сода каустик – Смесването на яйчен белтък със сода каустик няма да доведе до образуването на сапун.
Следователно, правилният отговор е:
В) мазнини със сода каустик
А) оцет
Б) олио
В) вино
Г) кисело мляко
РЕШЕНИЕ:
Разглеждайки предложените възможности за получаване на хранителни продукти чрез ферментация, нека си припомним, че процесът на ферментация е биохимичен процес, при който микроорганизми като бактерии, плесени и дрожди превръщат органични вещества в алкохоли, киселини и газове. Този процес е основен при производството на множество хранителни продукти и напитки.
А) Оцет – Получава се чрез ферментация на етилов алкохол (етанол), при която алкохолът се окислява до оцетна киселина. Това е бактериална ферментация, която се осъществява под влиянието на ацетобактерии.
Б) Олио – Производството на олио (масло), като например зехтин, не включва процеса на ферментация. Маслото се извлича чрез механично пресоване на семената или плодовете на растенията, като маслини, без да се налага микробиологично превръщане на съставките.
В) Вино – Производството на вино включва ферментация на гроздов сок, при която захарите се превръщат в алкохол и въглероден диоксид под влиянието на дрожди. Това е алкохолна ферментация.
Г) Кисело мляко – Производството на кисело мляко е резултат от млечнокисела ферментация, при която млечната захар (лактоза) се превръща в млечна киселина под влиянието на специфични бактерии. Тази киселина сгъстява млечните протеини, като по този начин се образува киселото мляко.
Като се има предвид горното описание, можем да заключим, че олиото (Б) е продуктът, който не се получава чрез ферментация.
А) калциеви йониБ) нитратни йони
В) хлоридни йониГ) амониеви йони
РЕШЕНИЕ:
Лаборантът използва разтвор, съдържащ сребърни йони (Ag+), за да докаже наличието на хлоридни йони (Cl-) в проба от минерален тор. Когато сребърният разтвор се добави към разтвор, съдържащ хлоридни йони, се образува бял, неразтворим във вода утайка на сребърен хлорид (AgCl):
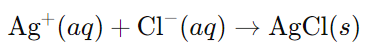
Този бял утайка на сребърен хлорид е характерна реакция за доказване на наличието на хлоридни йони в разтвор.
Следователно, правилният отговор е В) хлоридни йони.
А) да добави вода в разтвораБ) да прибави разтвор на AgNO3В) да нагрее разтвора и да изпари част от водата в него
Г) да прибавя солна киселина до разтваряне на CaCO3, след това да нагрее разтвора,
РЕШЕНИЕ:
За да получи разтвор, в който освен вода и нейните йони да се съдържат само йоните Na+, Cl– и Ca2+, ученикът трябва да предприеме стъпки, които ще позволят на CaCO3 да се разтвори във водата, тъй като в чист вид CaCO3 е слабо разтворим във вода.
Опция Г) да прибавя солна киселина до разтваряне на CaCO3, след това да нагрее разтвора, е най-подходящият избор. Прибавянето на солна киселина (HCl) в разтвора ще реагира с CaCO3, като го разтвори чрез следната реакция:
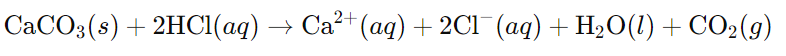
Така, калциевият карбонат реагира със солна киселина, като образува разтворими калциеви йони (Ca2+), хлоридни йони (Cl–), вода и газообразен въглероден диоксид (CO2), който избягва от разтвора. В резултат на това в разтвора остават желаните йони: Na+, Cl– и Ca2+.
Изпаряването на част от водата (опция В) може да концентрира разтвора, но само по себе си не премахва неразтворимия CaCO3 или не гарантира разтварянето му в разтвора. Добавянето на вода (опция А) просто ще разреди разтвора, а добавянето на разтвор на AgNO3 (опция Б) ще доведе до образуването на неразтворимия сребърен хлорид (AgCl), което не е целта на задачата.
А) KOH
Б) K2SO4
В) H2SO4
Г) C2H5OH
РЕШЕНИЕ:
Обработката на поразеното място с 2% разтвор на оцетна киселина след промиване с вода показва, че ученикът е влязъл в контакт с основа. Оцетната киселина (слаба органична киселина) се използва за неутрализиране на основното вещество, което може да причини химическо изгаряне. От изброените възможности, KOH (калиева основа) е силна основа и може да причини такива рани при контакт с кожата.
Б) K2SO4 (калиев сулфат) и В) H2SO4 (серна киселина) не са подходящи отговори, тъй като при контакт с кожата на ученика е било нужно неутрализиране с основа, а не с киселина, ако става въпрос за киселина. Г) C2H5OH (етанол) също не е вероятен отговор, тъй като етанолът не е корозивен и не би наложило подобна обработка при попадане върху кожата.
Следователно, правилният отговор е А) KOH.
Решения на Втори Модул
ОЧАКВАЙТЕ СКОРО!